الفكرة العامة لفصل حالات المادة
حقائق كيميائية يحتوي مقياس اليود للحرارة على عدة جرامات من اليود داخل كرة محكمة الإغلاق

كيف تؤثر السوائل المختلفة في سرعة كرة تتحرك فيها؟
المطويات حالات المادة

نظرية الحركة الجزيئية
الأهداف لدرس الغازات
يمكن التمييز بين بعض المواد بمجرد النظر إليها، ولكن هذا لا ينطبق على الكثير من الغازات.

حجم الجسيمات
تابع تفسير سلوك الغازات
أصل الكلمة غاز
فسر الأثر الذي تحدثه جسيمات الغاز بعضها في بعض بفعل التصادمات وماذا يحدث للجسيمات بعد هذه التصادمات؟

الانضغاط والتمدد
الانتشار والتدفق
اربط بين التغير في حجم الغاز وكثافة جسيماته في كل أسطوانة

إذا كانت الكتلة المولية للأمونيا هي 17.0 والكتلة المولية لكلوريد الهيدروجين هي 36.5 فاحسب نسبة معدل انتشارهما.
احسب ن سبة معدل التفدق ل كل من النيتروجين والنيون
تعتمد سرعة الانتشار بالدرجة الأولى على كتلة الجسيمات
وضح لماذا يعتمد معدل الانتشار على كتلة الجسيمات
احسب نسبة معدل الانتشار لكل من أول أكسيد الكربون وثاني أكسيد الكربون
ما معدل تدفق غاز كتلته المولية ضعف الكتلة المولية لغاز يتدفق بمعدل 3.6؟
ضغط الغاز
ضغط الهواء
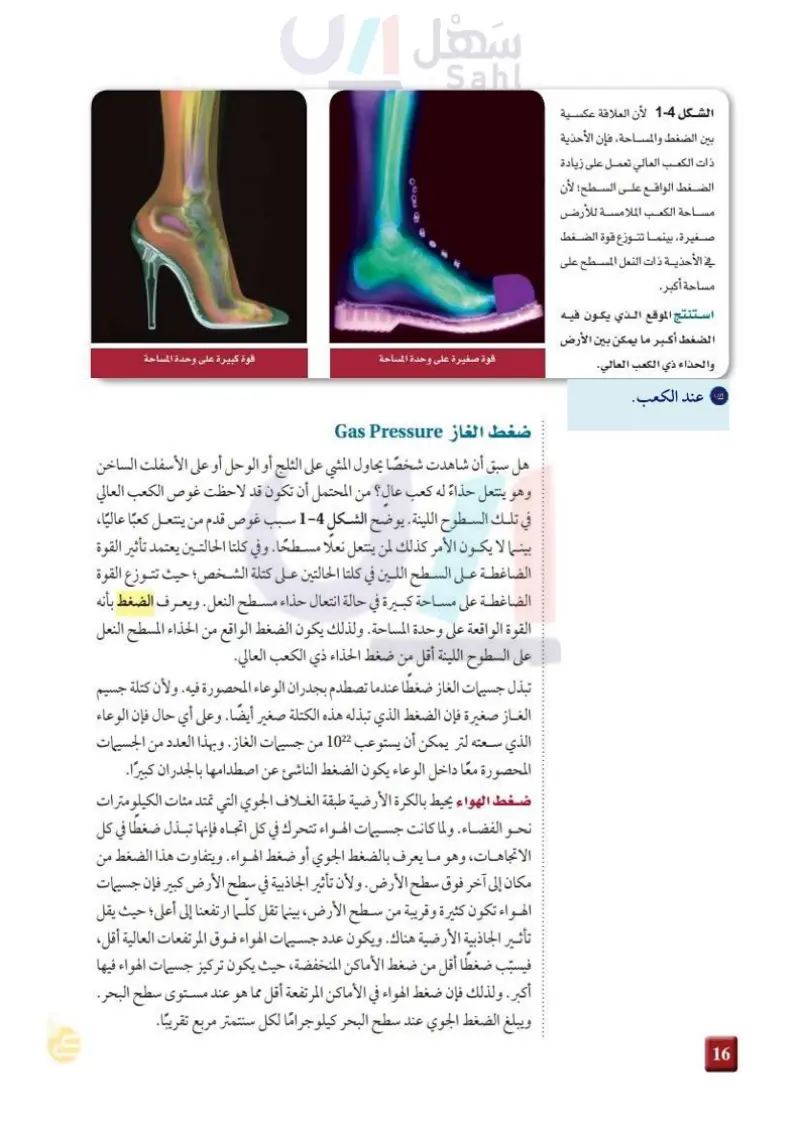
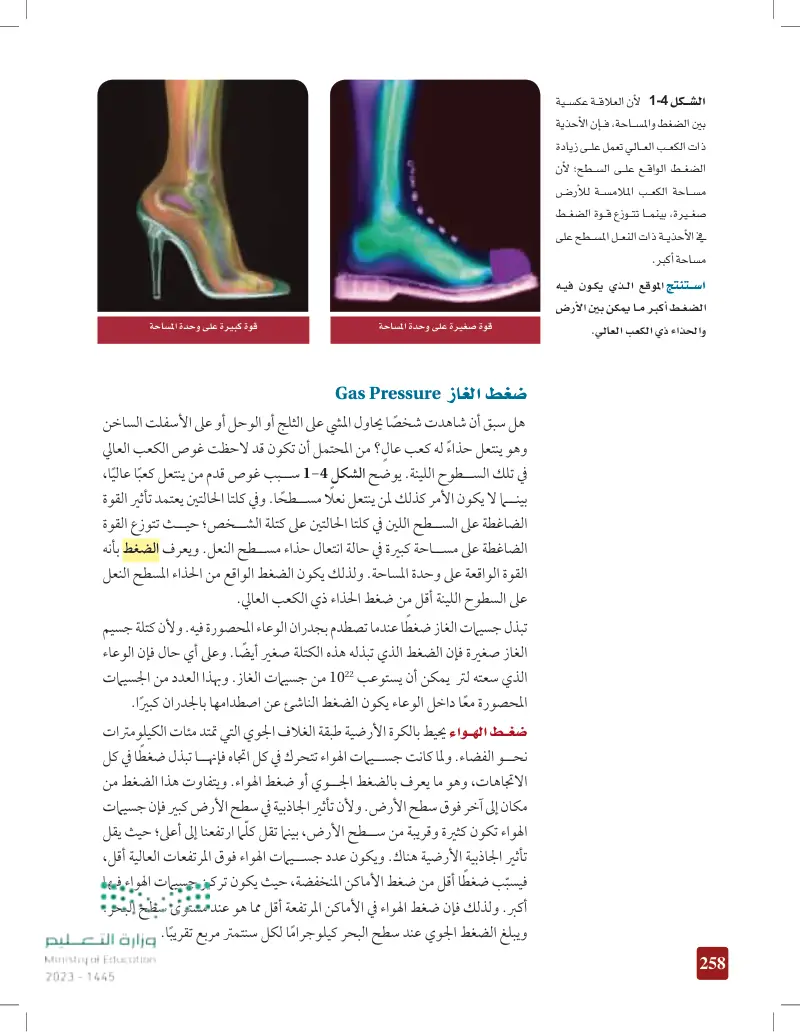
استنتج الموقع الذي يكون فيه الضغط أكبر ما يمكن ببين الأرض والحذاء ذي الكعب العالي
لأن علاقة عكسية بين الضغط والمساحة

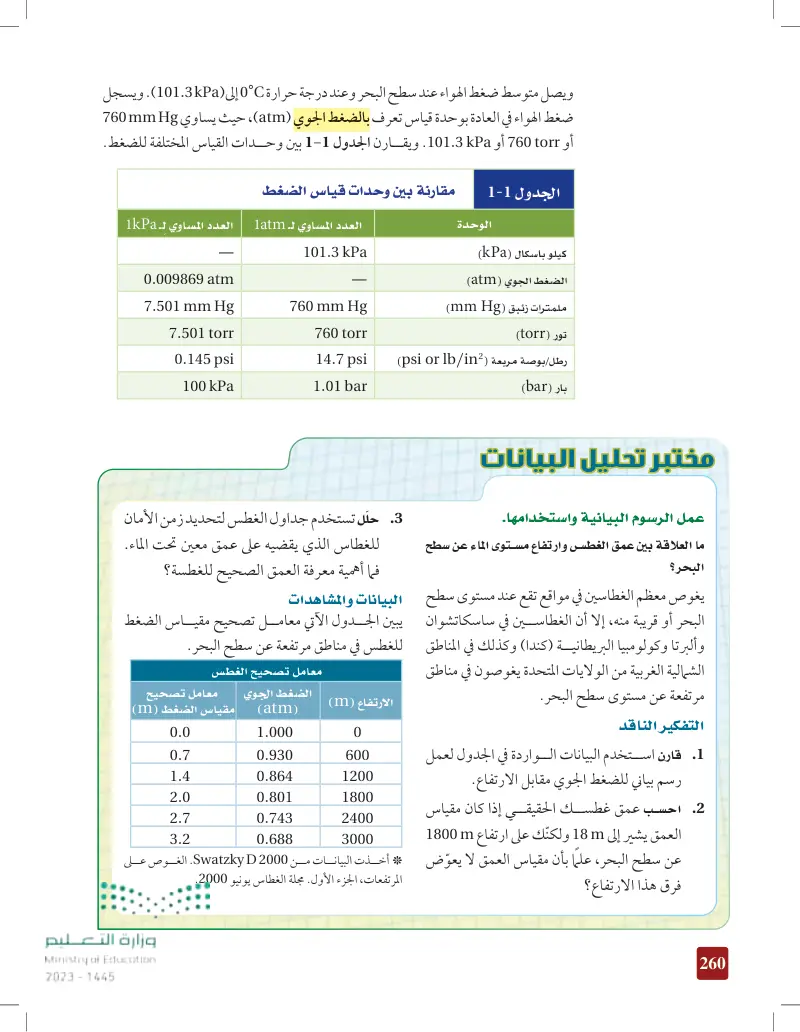
قياس الضغط الجوي
وحدات قياس الضغط
كان ثورشلي أول من صمم جهازا يبين أن للغلاف الجوي ضغطا
المانومتر جهاز يقيس ضغط الغاز المحصور
مقارنة بين وحدات قياس الضغط
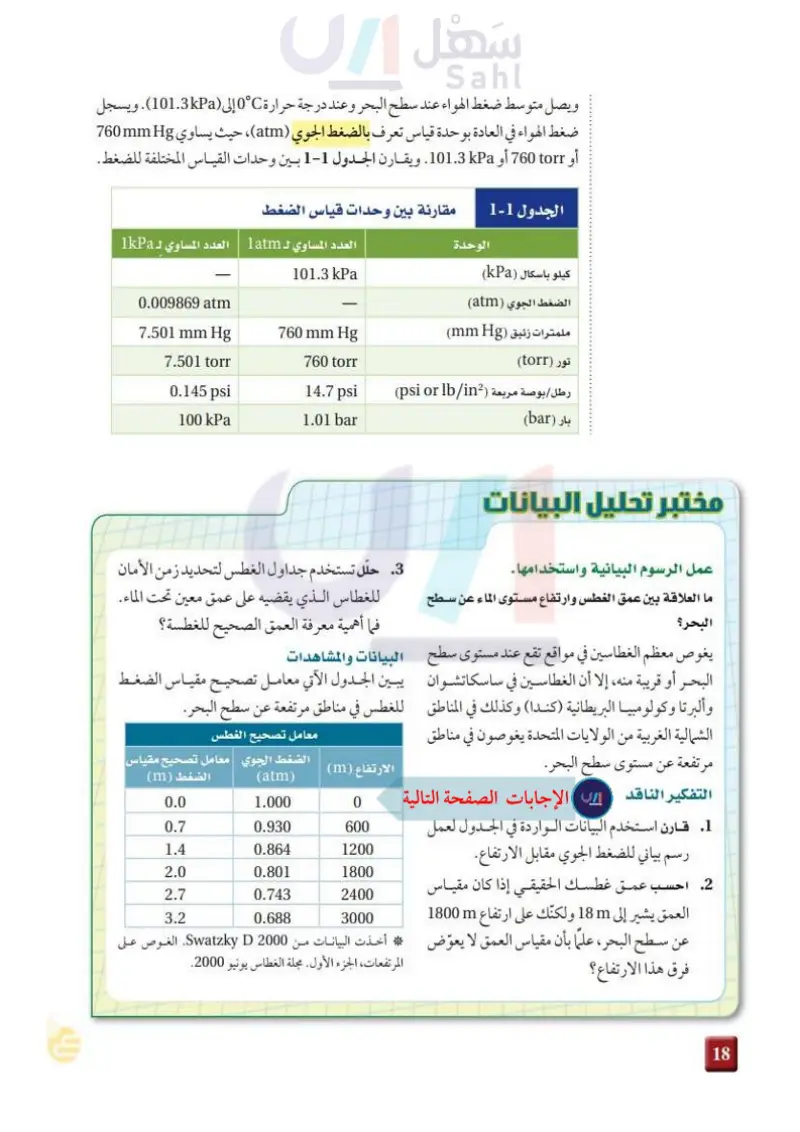
ما العلاقة بين عمق الغطس وارتفاع مستوى الماء عن سطح البحر؟

كيف تقارن بي الضغوط الجزئيه لغازي النيتروجين
قانون دالتون للضغوط الجزئية

إذا كان الضغط الكلي لخليط من الغازات مكوّنًا من الأكسجين وثاني أكسيد الكربون والنيتروجين يساوي 0.97 فاحسب الضغط الجزئي للأكسجين، علمًا بأن الضغط الجزئي لثاني أكسيد الكربون 0.70 وللنيتروجين 0
الضغط الجزئ ي لغزا الهيدروجين في خلي ط من غزا الهيليمو وغزا الهيدروج ، ين علمًا بأ ن الضغط الكلي 600 والضغط الجزئي للهيليوم يساوي 439
أوجد الضغط الكلي لخليط غاز مكوّن من أربعة غازات بضغوط جزئية على النحو الآتي
أوجد الضغط الجزئي لغاز ثاني أكسيد الكربون في خليط من الغازات، علمًا بأن ضغط الغازات الكلي يساوي 30.4 والضغوط الجزئية للغازين الآخرين هما 16.5 و 3.7
الهواء خليط من الغازات يحتوي على غاز النيتروجين بنسبة % 78 وغاز الأكسجين % 21 وغاز الأرجون %1 فما الضغوط الجزئية لكل من النيتروجين والأكسجين والأرجون في الهواء؟

استخدام قانون دالتون
الخلاصة يستخدم قانون جراهام للمقارنة بين معدل انتشار غازين
فسر سبب استخدام نظرية الحركة الجزئية لتفسير سلوك الغازات
وضح كيف يمكن قياس ضغط الغاز
احسب الضغط الجزئي لأحد الغازين المحصورين في وعاء، إذا علمت أن الضغط الكلي 1.20 والضغط الجزئي لأحدهما هو 0.75
احسب الضغط الجزئي لغاز الهيدروجين عند درجة حرارة 20 إذا علمت أن الضغط الكلي لخليط غاز الهيدروجين وبخار الماء هو 100.0
كيف تؤثر كتلة جسيم الغاز في معدل انتشاره وتدفقه؟
لماذا ينكس وعاء الماء عند جمع الغاز بإحلاله محل الماء؟
استنتج ما إذا كان لدرجة الحرارة تأثير في معدل انتشار الغاز، فسّر إجابتك.