التمهيد - الكيمياء - سادس اعدادي
التمهيد
الفصل الأول: الثرموداينمك
الفصل الثاني: الاتزان الكيميائي
الفصل الثالث: الاتزان الايوني
الفصل الرابع: تفاعلات التأكسد والاختزال والكيمياء الكهربائية
الفصل الخامس: الكيمياء التناسقية
الفصل السادس: طرائق التحليل الكيميائي
الفصل السابع: الكيمياء العضوية للهيدروكاربونات المعوضة
الفصل الثامن: الكيمياء الحياتية
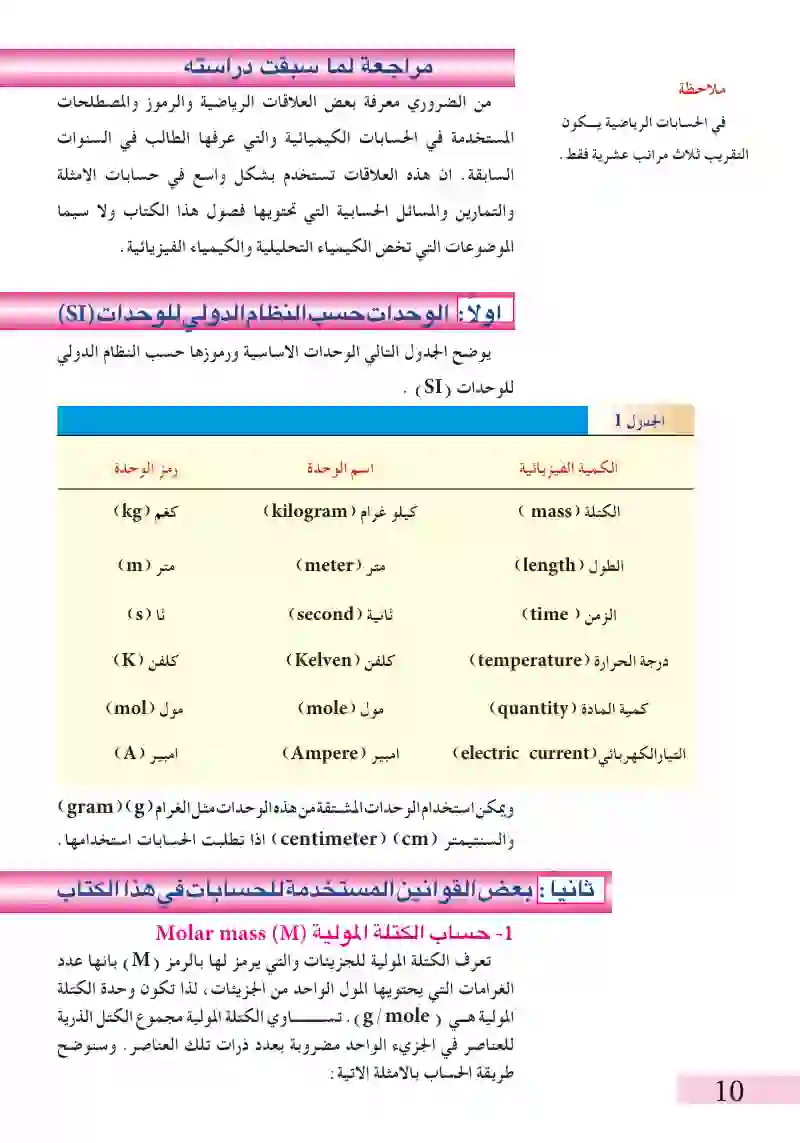
مراجعة لما سبق: الوحدات حسب النظام الدولي للوحدات
الوحدات حسب النظام الدولى للوحدات(SI)
بعض القوانين المستخدمة للحسابات: حساب الكتلة المولية
في الحسابات الرياضية يكون التقريب ثلاث مراتب عشرية فقط.

احسب الكتلة المولية لمركب كاربونات الصوديوم Na2CO3 و فوسفات الكالسيوم(Ca3)PO4. الكتل الذرية للعناصر: Na = 23 ; C = 12 ; O = 16 ; Ca = 40 ; P = 31
احسب الكتلة المولية للمركبات الاتية: KMnO4 NaOH وK2Cr2O7 وH2SO4 MgCl2. يمكن الحصول على الكتل الذرية للعناصر من الجدول الموجود في نهاية الكتاب
حساب عدد المولات
احسب عدد مولات كاربونات البوتاسيوم K2CO3 الموجودة في g 22 من هذا المركب.

علاقة عدد المولات لحساب الكتلة
احسب عدد الغرامات الموجودة في mole 0.15 من NaCl.
احسب عدد مولات كبريتات الصوديوم Na2SO4 الموجودة في g 14.2 من هذا المركب ج: mol 0.1
أجر الحسابات الآتية : احسب عدد مولات حامض الفسفوريك H3PO4 الموجودة في g72 من هذا المركب.
حساب المولارية
الفرق بين رمز التركيز المولاري والكتلة المولية

معادلة حساب المولارية
تم إذابة g 53 من كاربونات الصوديوم Na2CO3 في دورق حجمي سعته L 5. احسب التركيز المولاري لهذا المحلول
تم اذابة g 15 من حامض الخليك CH3COOH في mL 150 من الماء وضعت في دورق حجمي سعته نصف واكمل الحجم لحد العلامة. احسب مولارية هذا المحلول.
احسب عدد الغرامات من هيدروكسيد الكالسيوم 2(Ca)OH اللازمة لتحضير محلول تركيزه M 0.1 وحجمه mL 250
العلاقة بين وحدات الحجوم

حل مثال احسب عدد الغرامات من هيدروكسيد الكالسيوم 2(Ca)OH اللازمة لتحضير محلول تركيزه M 0.1 وحجمه mL 250
أذيب g 4 من هيدروكسيد الصوديوم NaOH mol/g 40=M في حجم معين من الماء وتم قياس مولارية المحلول وكانت تساوي L/ mole 0.05 احسب حجم الماء باللتر الذي أذيبت فيه العينة
العلاقة بين عدد الجزئيات أو الذرات والمول
ما هي عدد الذرات والجزيئات الموجودة في mole 0.1 من غاز الهيدروجين H2
احسب عدد الذرات والجزيئات الموجودة في mole 0.16 من غاز الأوكسجين O2.

اللوغاريتمات

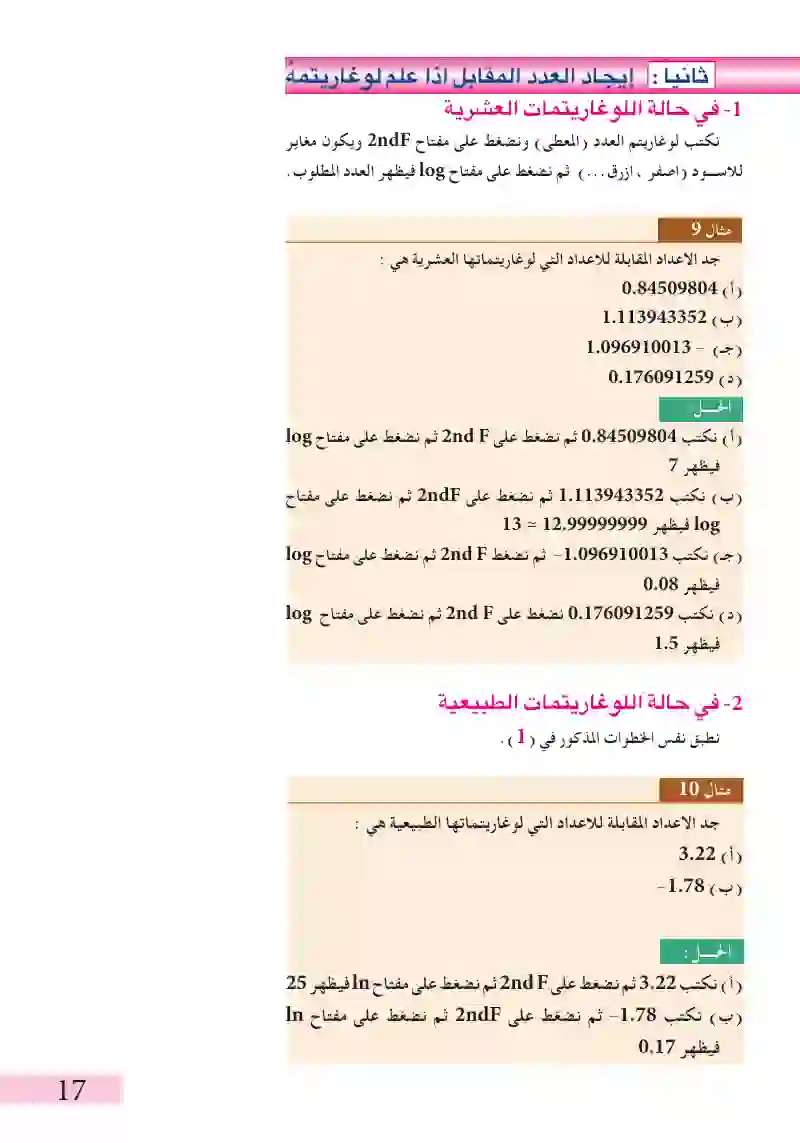
إيجاد لوغاريتم العدد في حالة اللوعاريتمات العشرية
جد قيم log 26.7
في حالة اللوغاريتمات الطبيعية
جد قيم y في العلاقات التالية باستخدام الحاسبة اليدوية، اي جد اللوغاريتم المقابل. log y = 2.6
إيجاد العدد المقابل في حالة اللوغاريتمات العشرية
في حالة اللوغاريتمات الطبيعية

المعادلات الرئيسية: العلاقة بين عدد المولات والكتلة المولية ( n)
المفاهيم الأساسية: الكتلة المولية





