الاس الهيدروجيني - الكيمياء - سادس اعدادي
التمهيد
الفصل الأول: الثرموداينمك
الفصل الثاني: الاتزان الكيميائي
الفصل الثالث: الاتزان الايوني
الفصل الرابع: تفاعلات التأكسد والاختزال والكيمياء الكهربائية
الفصل الخامس: الكيمياء التناسقية
الفصل السادس: طرائق التحليل الكيميائي
الفصل السابع: الكيمياء العضوية للهيدروكاربونات المعوضة
الفصل الثامن: الكيمياء الحياتية

تبين هذه العلاقة أن قيمتي pH و pOH لمحلول تكون كلتاهما موجبة إذا كانتا أقل من 14، أما في حال كون إحداهما أكبر من 14 فعندها ستكون قيمة الأخرى سالبة

يستخدم في الوقت الحاضر مصطلح "p" للتعبير عن تراكيز الأيونات الأخرى (غير +H و OH)،و بشكل عام يقصد عند إضافة الحرف الصغير p" قبل الرمز، سالب لوغارتم ذلك الرمز (و يدعى بدالة p)
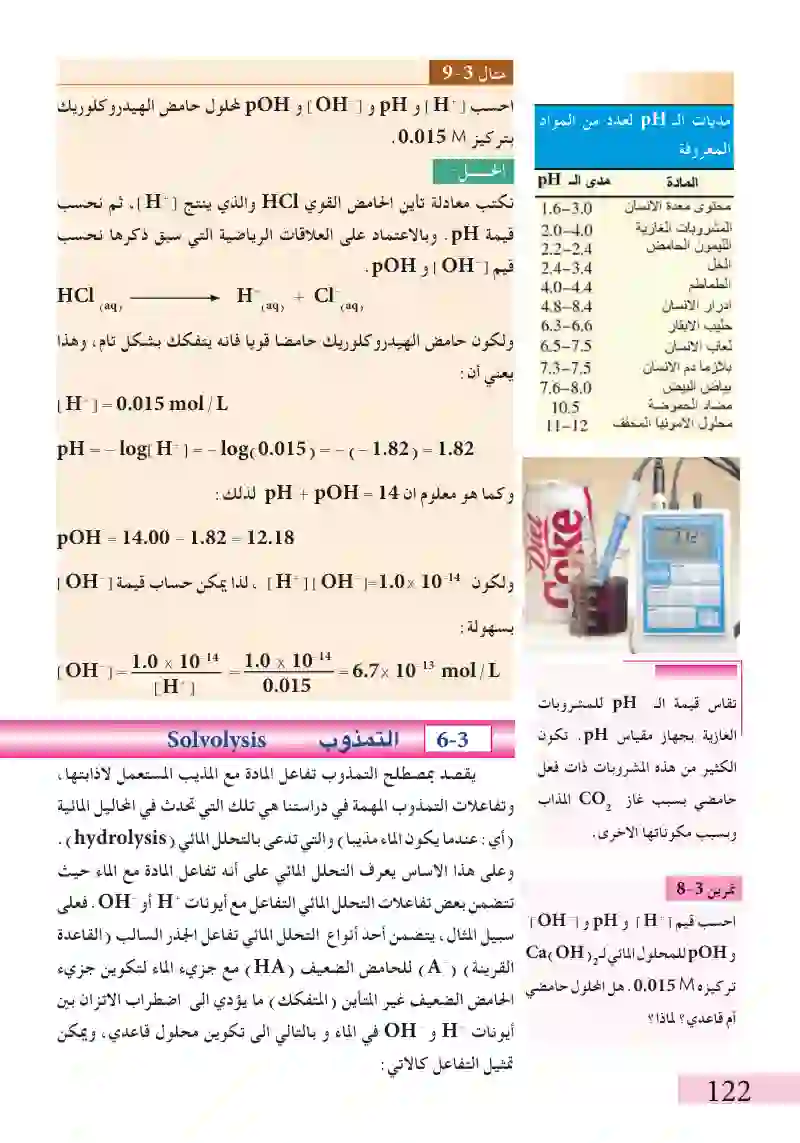
مديات الـ pH لعدد من المواد المعروفة


لم يتم إضافة أي تعليقات حتى الآن.
الرجاء تسجيل الدخول لكتابة تعليق







