قوة الأحماض والقواعد - الكيمياء 3 - ثالث ثانوي
الفصل1: المخاليط والمحاليل
الفصل2: الأحماض والقواعد
الفصل3: تفاعلات الأكسدة والاختزال
الفصل4: الكيمياء الكهربائية
مصادر تعليمية للطالب
رابط الدرس الرقمي 2-2 الأهداف قوة الأحماض والقواعد تربط قوة الحمض Strengths of Acids and Bases والقاعدة مع درجة تأينهما. تقارن قوة حمض ضعيف بقوة قاعدته المرافقة. www.ien.edu.sa الفكرة الرئيسة تتأين الأحماض والقواعد القوية في المحاليل تأينًا تامًا، بينما تتأين الأحماض والقواعد الضعيفة في المحاليل تأينا جزئيًا. الربط مع الحياة تعتمد التمريرة الناجحة في لعبة كرة القدم على كل من المرسل والمستقبل ) تشرح العلاقة بين قوى فيعرف مثلاً مدى استعداد المرسل لتمرير الكرة، ومدى استعداد المستقبل لاستقبال الكرة. الأحماض والقواعد وقيم وكذلك الحال في تفاعلات الأحماض والقواعد؛ حيث يعتمد سير التفاعل على مدى استعداد الحمض لمنح أيون الهيدروجين، ومدى استعداد القاعدة لاستقباله. ثوابت تأينها. مراجعة المفردات الحمض القوي الحمض الضعيف قوة الأحماض Strengths of Acids إلكتروليت: مادة يوصل محلولها من خواص المحاليل الحمضية والقاعدية أنها توصل الكهرباء. ما المعلومات التي تستطيع معرفتها المائي التيار الكهربائي. عن أيونات الهيدروجين وأيونات الهيدروكسيد في هذه المحاليل المائية من خلال توصيلها للكهرباء؟ المفردات الجديدة افترض أنك تفحص قدرة التوصيل الكهربائي لمحلول مائي تركيزه 0.10M من حمض الهيدروكلوريك، وآخر مماثل من حمض الإيثانويك (الخل). يدل توهج المصباح الكهربائي في الشكل 11-2 على أن المحلول يوصل الكهرباء. ولكن إذا قارنت توهج المصباح المتصل بمحلول HCl في الشكل 11-2 بتوهج المصباح المتصل بمحلول CH COOH في الشكل 12-2 فلا بد أن تلاحظ فرقًا؛ فتوصيل محلول HCI للكهرباء أفضل من توصيل محلول CH COOH. فلمَ هذا الفرق مع أن تركيزي الحمضين متساويان؟ الأحماض القوية يعتمد توصيل التيار الكهربائي على عدد الأيونات في المحلول. وقد تأينت جزيئات HC الموجودة في المحلول جميعها كليا مكونةً أيونات هيدرونيوم وأيونات كلوريد. ثابت تأين الحمض القاعدة القوية القاعدة الضعيفة ثابت تأين القاعدة الشكل 11-2 يتوهج المصباح بقوة عندما يوضع القطبان في محلول حمض الهيدروكلوريك بتركيز 0.10 ؛ لأن جميع HCl تتحلل إلى أيونات هيدرونيوم وأيونات كلوريد. أيون الهيدرونيوم وزارة التعليم Ministry of Education 2024-1446 + أيون كلوريد 66

MCILEDOM + جزيء حمض الإيثانويك (حمض الخل أيون أسيتات خلات) أيون هيدرونيوم الشكل 12-2- عند وضع الأقطاب في محلول حمض الإيثانويك بتركيز 0.10 يكون الضوء خافتًا. .. قارن هذه الصورة بالشكل 11-2. فسّر الفرق بين شدتي إضاءة المصباحين بحسب تركيز الأيونات في المحلول. وتسمى الأحماض التي تتأين كليا أحماضًا قوية. ولأن الأحماض القوية تنتج أكبر عدد من الأيونات، لذا فهي موصلات جيدة للكهرباء. يمكن تمثيل تأين حمض الهيدروكلوريك في الماء بالمعادلة الآتية: HCl(aq) + H2O(1) → H3O+ (aq) + Cl¯¯(aq) عدد الأحماض الضعيفة إذا كان سبب الإضاءة القوية لمصباح الجهاز الذي يحتوي على HCI هو الأيونات الكبير في المحلول - كما في الشكل 11-2 - فإن الإضاءة الخافتة لمصباح الجهاز الذي يحتوي على محلول CH COOH، المبين في الشكل 212 لا بد أن يكون سببها احتواء محلول حمض الإيثانويك (الخل) على عدد أقل من الأيونات. ولأن المحلولين يحتويان على التركيز المولاري نفسه لذا أن نستنتج حمض الإيثانويك لا يتأين كليًّا. ولذلك يسمى الحمض الذي يتأين جزئيًا فقط في المحلول المائي المخفف الحمض الضعيف. ولأن الأحماض الضعيفة تنتج أيونات أقل فإنها لا توصل الكهرباء جيدًا مثل الأحماض القوية. ويبين الجدول - معادلات التأين لبعض الأحماض الضعيفة والأحماض القوية الشائعة. الجدول 3-2 معادلات التأين أحماض قوية معادلات التأين أحماض ضعيفة الاسم معادلات التأين الهيدروفلوريك الإيثانويك كبريتيد الهيدروجين HF = H+ + F- CH3COOH H++C2H3O2¯ H2S = H+ + HS- الكربونيك الهيبوكلوروز H2CO3 + H+ + HCO3- HCIOH+ + Clo¯ 67 وزار سليم Ministry of Education 2024-1446 HCl → H+ + CI- -I + +H ← IH HClO4 → H+ + ClO4¯ HNO3 → H+ + NO3 H2SO4 → H+ + HSO4- الاسم الهيدروكلوريك الهيدرويوديك البيركلوريك النيتريك الكبريتيك

واقع الكيمياء في الحياة سيانيد الهيدروجين قوة الحمض ونظرية برونستد - لوري هل تستطيع نظرية برونستد – لوري تفسير ، تأين HCl كليا بينما يكون HC HO القليل من الأيونات؟ تأمل تأين أي حمض قوي، كحمض HX على سبيل المثال. وتذكّر أن الحمض الموجود على جهة المواد المتفاعلة ينتج قاعدة مرافقة على جهة النواتج. وبالمثل فإن القاعدة الموجودة على جهة من المعادلة المواد المتفاعلة تنتج حمضًا مرافقًا. O HX (aq) + H2O (1) → H3O+ (aq) +X¯ (aq) قاعدة مرافقة حمض مرافق قاعدة حمض يمثل HX حمضًا قويًا وقاعدته المرافقة ضعيفة. أي أن HX يتأين بنسبة %100 تقريبًا؛ لأن الماء قاعدة أقوى ( في التفاعل الأمامي) من قاعدته المرافقة X ( في التفاعل العكسي). أي أنه يقع اتزان التأين كليًّا تقريبًا إلى اليمين؛ لأن جذب القاعدة H2O لأيون H أكبر مركب مميت سيانيد الهيدروجين من جذب القاعدة المرافقة .. فكر في هذا الأمر وكأنه معركة للقواعد، أيهما لديه قوة جذب أكبر لأيون الهيدروجين: H2O أم X؟ الماء هو القاعدة الأقوى عندما تكون الأحماض كلها قوية. لاحظ أن المعادلة مبينة بسهم واحد إلى اليمين. HCN غاز سام يوجد في عوادم المركبات، وفي دخان التبغ والخشب، وفي دخان البلاستيك المحترق المحتوي على النيتروجين. وتطلق بعض الحشرات كيف يختلف الوضع لأي حمض ضعيف HY؟ سيانيد الهيدروجين للدفاع عن نفسها. ويسمى محلول سيانيد الهيدروجين في الماء حمض الهيدروسيانيك. وتحتوي HY(aq) + H2O(1) ⇒ H3O+ (aq) + Y¯(AQ) قاعدة مرافقة حمض مرافق قاعدة حمض نوى بعض الفواكه ومنها الكرز يميل اتزان التأين للحمض الضعيف إلى يسار المعادلة؛ لأن القاعدة المرافقة Y لديها والخوخ على سيانوهيدرين الذي جذب أكبر لأيون الهيدروجين من القاعدة .. وتعد القاعدة المرافقة Y (في التفاعل يتحول إلى حمض الهيدروسيانيك في العكسي) أقوى من القاعدة H في التفاعل الأمامي)، وتستطيع أن تستولي على الجهاز الهضمي إذا أكلت النواة. ولكن أيون .H. فمثلاً في حالة حمض الإيثانويك (الخل) تعد القاعدة المرافقة (في التفاعل لا يوجد حمض الهيدروسيانيك في لب العكسي) أقوى في جذب أيونات الهيدروجين من القاعدة HO ( في التفاعل الأمامي). هذه الثمار، لذا يمكن أكله بأمان. H3O+ (aq) + C2H3O2¯¯(aq) HC2H3O2(aq) + H2O(1) = H3O+ لاحظ أن المعادلة تحتوي على سهمي اتزان. ماذا قرأت؟ لخص أهم الاختلافات بين الأحماض القوية والأحماض الضعيفة عند تفاعلها مع القواعد. ثابت تأين الحمض تساعد نظرية برونستد - لوري على تفسير قوة الأحماض، إلا أنها لا تعبر بطريقة كمية عن قوة الحمض ، ولا تقارن بين قوى الأحماض المختلفة. لذا يعد تعبير ثابت الاتزان قياسًا كميا لقوة الحمض. إن الحمض الضعيف ينتج خليط اتزان من الجزيئات والأيونات في المحلول المائي. لذا يعطي ثابت الاتزان Ken قياسًا كميّا لدرجة تأين الحمض تأمل حمض الهيدروسيانيك HCN، الذي يستعمل في الصباغة والحفر على الفولاذ، وتليينه. 68 وزارة التعليم Ministry of Education 2024-1446

سيانيد الهيدروجين
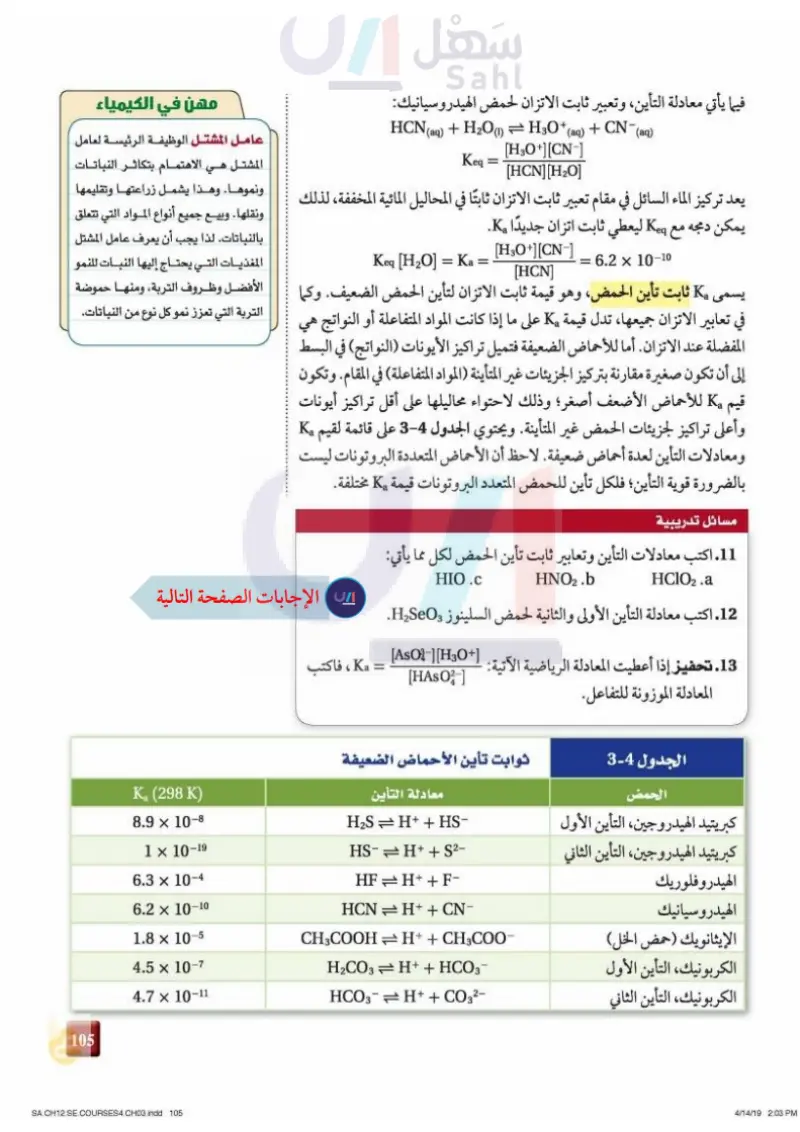
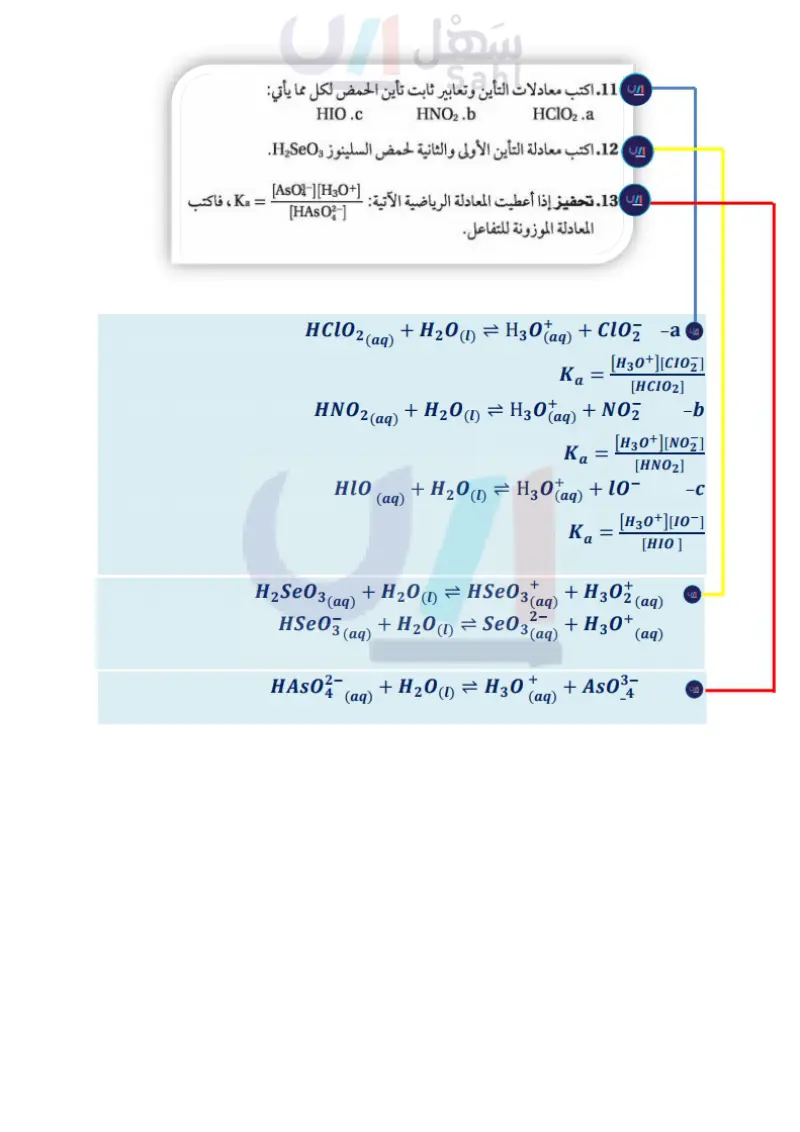
فيما يأتي معادلة التأين، وتعبير ثابت الاتزان لحمض الهيدروسيانيك: HCN (aq) + H2O(1) = H3O+ (aq) + CN¯¯(aq) = Keq [H3O+] [CN-] [HCN] [H₂O] مهن في الكيمياء عامل المشتل الوظيفة الرئيسة لعامل المشتل هي الاهتمام بتكاثر النباتات ونموها. وهذا يشمل زراعتها وتقليمها يعد تركيز الماء السائل في مقام تعبير ثابت الاتزان ثابتا في المحاليل المائية المخففة، لذلك يمكن دمجه مع Keg ليعطي ثابت اتزان جديدًا K. يسمى 6.2 × 10-10 = Keq [H2O] = Ka = [H3O+] [CN-] [HCN] ونقلها . وبيع جميع أنواع المواد التي تتعلق بالنباتات. لذا يجب أن يعرف عامل المشتل المغذيات التي يحتاج إليها النبات للنمو Ka ثابت تأين الحمض، وهو قيمة ثابت الاتزان لتأين الحمض الضعيف. وكما الأفضل وظروف التربة، ومنها حموضة التربة التي تعزز نمو كل نوع من النباتات. في تعابير الاتزان جميعها، تدل قيمة Ka على ما إذا كانت المواد المتفاعلة أو النواتج هي المفضلة عند الاتزان. أما للأحماض الضعيفة فتميل تراكيز الأيونات (النواتج) في البسط إلى أن تكون صغيرة مقارنة بتركيز الجزيئات غير المتأينة (المواد المتفاعلة) في المقام. وتكون قیم K للأحماض الأضعف أصغر؛ وذلك لاحتواء محاليلها على أقل تراكيز أيونات وأعلى تراكيز الجزيئات الحمض غير المتأينة. ويحتوي الجدول 4-2 على قائمة لقيم Ka ومعادلات التأين لعدة أحماض ضعيفة. لاحظ أن الأحماض المتعددة البروتونات ليست بالضرورة قوية التأين؛ فلكل تأين للحمض المتعدد البروتونات قيمة K مختلفة. مسائل تدريبية 11. اكتب معادلات التأين وتعابير ثابت تأين الحمض لكل مما يأتي: HClO2.a HNO2.b HIO.C 12. اكتب معادلة التأين الأولى والثانية لحمض السلينوز H2SeO. 13. تحفيز إذا أعطيت المعادلة الرياضية الآتية: = [AsO-][H3O+] [HASO-] Ka ، فاكتب المعادلة الموزونة للتفاعل. الجدول 4-2 الحمض كبريتيد الهيدروجين، التأين الأول كبريتيد الهيدروجين، التأين الثاني الهيدروفلوريك الهيدروسيانيك الإيثانويك (حمض الخل) الكربونيك، التأين الأول الكربونيك، التأين الثاني ثوابت تأين الأحماض الضعيفة معادلة التأين Ka (298 K) 8.9 × 10-8 1 × 10-19 6.3 × 10-4 6.2 × 10-10 H2S = H+ + HS- HS- = H+ + S2- HF = H+ + F- HCN = H+ + CN- CH3COOH = H+ + CH3COO- 1.8 × 10-5 4.5 × 10-7 4.7 x 10-11 H2CO3 + H+ + HCO3 HCO3- = H+ + CO32- 69 وزارت است سليم Ministry of Education 2024-1446

عامل المشتل
قرية قارن بين قوى الأحماض كيف تستطيع أن تحدد القوى النسبية للمحاليل الحمضية؟ الخطوات BIOPS 1. املأ بطاقة السلامة في دليل التجارب العملية. 5. أعد الخطوة 4 باستعمال حمض الإيثانويك الذي تركيزه 1.0 وحمض الإيثانويك 0.10 والفجوتين 3 و A4 على التوالي. التحليل 1. اكتب معادلة تأين حمض الإيثانويك في الماء، وتعبير ثابت الاتزان eq 2. استعمل مخبارًا مدرجًا سعته 10mL لقياس 3mL من حمض (10-5 × 1.8 = Keg ) . علام تدل قيمة Ken فيما يخص درجة التأين؟ الإيثانويك المركز. استعمل القطارة لنقل الحمض إلى الفجوة .1 .2 اشرح هل تتفق نسب التأين المئوية التقريبية الآتية نتائجك؟ مع من طبق التفاعلات البلاستيكي ذي الأربع والعشرين فجوة. ويمكنك حمض الإيثانويك ( حمض الخل) المركز استخدام أنابيب الاختبار كبديل في حالة عدم توفر طبق التفاعلات. حمض الإيثانويك 6.0 0.1 تحذير حمض الإيثانويك (الخل) المركز مادة أكالة وسامة عند .3 الاستنشاق؛ لذا تعامل معها بحذر. ضع قطبي جهاز الموصلية الكهربائية ( الدائرة الكهربائية) في الفجوة A1 ، وسجّل ملاحظاتك. حمض الإيثانويك 0.2،1.0 حمض الإيثانويك 0.4،1.0 حمض الإيثانويك 1.3،0.1 3. اقترح فرضية تشرح ملاحظاتك مستعينًا في ذلك بإجابتك عن السؤال 2. 4. اغسل المخبار المدرّج والقطارة بالماء، ثم قس 3mL من حمض ..4 استعمل فرضيتك للتوصل إلى استنتاج يتعلق بضرورة استعمال كميات الإيثانويك 6.0 وضعها في الفجوة A2 من طبق التفاعلات. افحص موصلية المحلول وسجلها. كبيرة من الماء للغسل عندما ينسكب حمض على نسيج حي. قوة القواعد Strengths of Bases الجدول تطلق القواعد أيونات OH، ويعتمد توصيل القاعدة للتيار الكهربائي على مقدار ما تنتجه من أيونات OH في المحلول المائي. القواعد القوية القاعدة التي تتحلل كليًّا منتجة أيونات فلزية وأيونات الهيدروكسيد تعرف بأنها قاعدة قوية. لذا فهيدروكسيدات الفلزات - ومنها هيدروكسيد الصوديوم NaOH - قواعد قوية. → Na+ NaOH(s) (aq) + OH- (aq) OH(aq) تعد بعض هيدروكسيدات الفلزات - ومنها هيدروكسيد الكالسيوم 2(Ca(OH - مصدرًا ضعيفًا لأيونات OH ؛ لأن ذائبيتها منخفضة. لاحظ أن ثابت حاصل الذائبية Kp لهيدروكسيد sp الكالسيوم 2(Ca(OH صغير، مما يدل على أن كمية قليلة من OH توجد في المحلول المشبع. معادلات التأين للقواعد القوية ومع 2-5 NaOH(s) → Na+ (aq) + OH- (aq) →K+ (aq) + OH¯(aq) → Rb + (aq) + OH (aq) Ca2+ Ca(OH)2(s) (aq) +20H¯(aq) Ksp = 6.5 × 10-6 ذلك فإن هيدروكسيد الكالسيوم وغيره من هيدروكسيدات الفلزات القليلة الذوبان قواعد قوية؛ لأن كل ما يذوب منها يتأيَّن كليًّا. ويبين الجدول - معادلات تحلل بعض (ی)KOH القواعد القوية RbOH(s) → CS+ (aq) + OH¯(aq) →Ca2+ (aq) + 20H¯(aq) + 2OH (aq) CSOH(s 1(s) Ca(OH) 2(5) Ba(OH)2(5) →Ba2+ (aq) القواعد الضعيفة تتأين القواعد الضعيفة جزئيًا فقط في المحاليل المائية المخففة. فمثلاً يتفاعل ميثيل أمين CH3NH2 مع الماء لينتج مخلوطًا متزنا من جزيئات CHNH2، + وأيونات CH NH3، وأيونات .-OH. + OH (aq) CH3NH2(aq) + H2O(1) = CH3NH3(aq) 70 قاعدة مرافقة حمض مرافق حمض قاعدة وزارة التعليم Ministry of Education 2024-1446

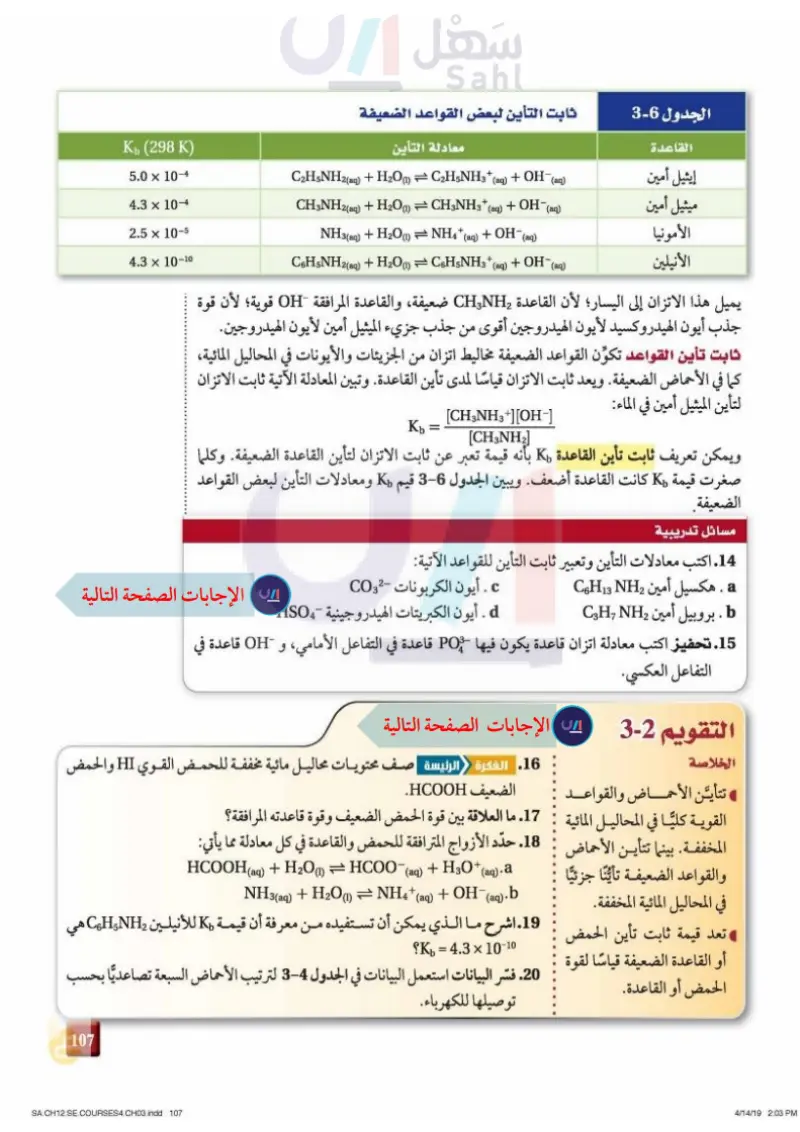
الجدول 6-2 ثابت التأين لبعض القواعد الضعيفة القاعدة إيثيل أمين ميثيل أمين الأمونيا الأنيلين Kb (298 K) 5.0 × 10-4 4.3 × 10-4 2.5 × 10-5 -10 4.3 × 10- معادلة التأين C2H5NH2(aq) + H2O(1) = C2H5NH3* (aq) + OH¯(aq) CH3NH2(aq) + H2O(1) = CH3NH3+ (aq) + OH¯(aq) + H2O(1) = NH4+ (aq) + OH¯(aq) NH3(aq) + H2O(1) C6H5NH2(aq) + H2O(1) = C6H5NH3+(aq) + OH¯ (aq) يميل هذا الاتزان إلى اليسار؛ لأن القاعدة CHNH2 ضعيفة والقاعدة المرافقة OH قوية؛ لأن قوة جذب أيون الهيدروكسيد لأيون الهيدروجين أقوى من جذب جزيء الميثيل أمين لأيون الهيدروجين. ثابت تأين القواعد تكوّن القواعد الضعيفة مخاليط اتزان من الجزيئات والأيونات في المحاليل المائية، كما في الأحماض الضعيفة. ويعد ثابت الاتزان قياسًا لمدى تأين القاعدة. وتبين المعادلة الآتية ثابت الاتزان لتأين الميثيل أمين في الماء: [CH3NH3+][OH-] [CH3NH2] Kb = ويمكن تعريف ثابت تأين القاعدة K بأنه قيمة تعبر عن ثابت الاتزان لتأين القاعدة الضعيفة. وكلما صغرت قيمة K كانت القاعدة أضعف. ويبين الجدول - قيم ومعادلات التأين لبعض القواعد الضعيفة. مسائل تدريبية 14. اكتب معادلات التأين وتعبير ثابت التأين للقواعد الآتية: a . هكسيل أمين CH13 NH2 b. بروبيل أمين CH NH2 c . أيون الكربونات CO2 d . أيون الكبريتات الهيدروجينية -HSO4 15. تحفيز اكتب معادلة اتزان قاعدة يكون فيها PO- قاعدة في التفاعل الأمامي، و OH قاعدة في 4 التفاعل العكسي. التقويم 2-2 الخلاصة 16. الفكرة الرئيسة صف محتويات محاليل مائية مخففة للحمض القوي HI والحمض تتأين الأحماض والقواعد الضعيف HCOOH . القوية كليا في المحاليل المائية 17. ما العلاقة بين قوة الحمض الضعيف وقوة قاعدته المرافقة ؟ المخففة. بينما تتأين الأحماض 18. حدّد الأزواج المترافقة للحمض والقاعدة في كل معادلة مما يأتي: والقواعد الضعيفة تأينا جزئيًا HCOOH(aq) + H2O = HCOO- (1) (aq) + H3O+ (aq).a 4' (aq) NH3(aq) + H2O(1) = NH4+ + OH- (aq).b في المحاليل المائية المخففة. تعد قيمة ثابت تأين الحمض : 19. اشرح ما الذي يمكن أن تستفيده من معره 19. اشرح ما الذي يمكن أن تستفيده من معرفة أن قيمة K للأنيلين CHNH2 أو القاعدة الضعيفة قياسًا لقوة الحمض أو القاعدة. 10-10 × 4.3 = K؟ هي 20. فسّر البيانات استعمل البيانات في الجدول - لترتيب الأحماض السبعة تصاعديا بحسب توصيلها للكهرباء. 71 وزارة ليم Ministry of Education 2024-1446

ما العلاقة بين قوة الحمض الضعيف وقوة قاعدته المرافقة
فسر البيانات استعمل البيانات في الجدول 4-2 لترتيب الأحماض السبعة تصاعديا بحسب توصيلها للكهرباء