وزن معادلات الأكسدة والاختزال - الكيمياء 3 - ثالث ثانوي
الفصل1: المخاليط والمحاليل
الفصل2: الأحماض والقواعد
الفصل3: تفاعلات الأكسدة والاختزال
الفصل4: الكيمياء الكهربائية
مصادر تعليمية للطالب
رابط الدرس الرقمي 3-2 الأهداف تربط التغير في عدد التأكسد بانتقال الإلكترونات. تستعمل التغير في عدد الأكسدة وزن معادلات الأكسدة والاختزال Balancing Redox Reactions الفكرة www.ien.edu.sa الرئيسة تصبح معادلات الأكسدة والاختزال موزونة عندما تكون الزيادة الكلية في أعداد التأكسد مساوية للانخفاض الكلي في أعداد التأكسد للذرات لوزن معادلات الأكسدة والاختزال. تزن معادلة الأكسدة والاختزال الأيونية الكلية مستعملا طريقة نصف التفاعل. مراجعة المفردات الداخلة في التفاعل. الربط مع الحياة عندما تفسد المواد الدهنية في الأطعمة، يقال إنها أصبحت حمضية؛ إذ تتكسر الجزيئات الكبيرة خلال تفاعلات الأكسدة والاختزال منتجة رائحة كريهة. وتعد الله المعادلة الخاصة بهذه العملية معقدة جدّا ، ولكننا نستطيع وزنها باستعمال القواعد نفسها التي استعملناها في وزن المعادلات الأبسط. طريقة عدد التأكسد The Oxidation-Number Method المعادلة الأيونية الكلية يجب وزن المعادلات الكيميائية لتوضيح الكميات الصحيحة للمتفاعلات والنواتج. معادلة أيونية تتضمن الجسيمات لذا ادرس المعادلات غير الموزونة الآتية للتفاعل الذي يحدث عندما يوضع النحاس في المشاركة في التفاعل فقط. محلول مركز من حمض النيتريك، كما في الشكل .36. ينتج غاز بني اللون هو ثاني أكسيد النيتروجين NO2 من اختزال أيونات النترات NO ، أما المحلول الأزرق فينتج عن تأكسد النحاس Cu إلى أيون النحاس (Cut (II. المفردات الجديدة طريقة عدد التأكسد نصف التفاعل Cu(NO3)2(aq) + NO2(g) + H2O (1) →> Cu(s) + HNO3(aq) لاحظ أن الأكسجين يظهر فقط في مادة متفاعلة واحدة هي HNO، ولكنه يظهر في النواتج الثلاثة جميعها، أما النيتروجين فيظهر في HNO3 وفي اثنين من النواتج. مثل معادلة الشكل - من الصعب الأكسدة والاختزال هذه التي يظهر فيها العنصر نفسه في عدة مواد متفاعلة وناتجة يصعب أحيانًا وزن بعض المعادلات وزنها. وكما تعلم، فعندما تفقد الذرة الإلكترونات يزداد عدد تأكسدها، وعندما تكتسب الكيميائية كما في تفاعلات الذرة الإلكترونات يقل عدد تأكسدها. ويجب أن يساوي عدد الإلكترونات المكتسبة عدد الأكسدة والاختزال بين النحاس الإلكترونات المفقودة. ولذا يجب أن يكون مجموع الزيادة في عدد التأكسد مساويًا لمجموع وحمض النيتريك؛ لأن العناصر الانخفاض في أعداد التأكسد للذرات المشتركة في التفاعل وتسمى مثل هذه الطريقة تظهر أكثر من مرة في كل جهة طريقة عدد التأكسد، وتعتمد على المبادئ في الجدول 4-3 من المعادلة. الجدول 4-3 طريقة عدد التأكسد حدّد أعداد التأكسد لجميع الذرات في المعادلة. حدّد الذرات التي تأكسدت والذرات التي اختزلت. حدّد التغير في عدد التأكسد للذرات التي تأكسدت والذرات التي اختزلت. اجعل التغير في أعداد التأكسد متساويًا في القيمة؛ وذلك بضبط المعاملات في المعادلة. استعمل الطريقة التقليدية في وزن المعادلة الكيميائية الكلية، إذا كان ذلك ضروريًا. 113 وزارت ليم Ministry of Education 2024-1446

من الصعب أحيانا وزن بعض المعادلات الكيميائية كما في تفاعلات الأكسدة والاختزال
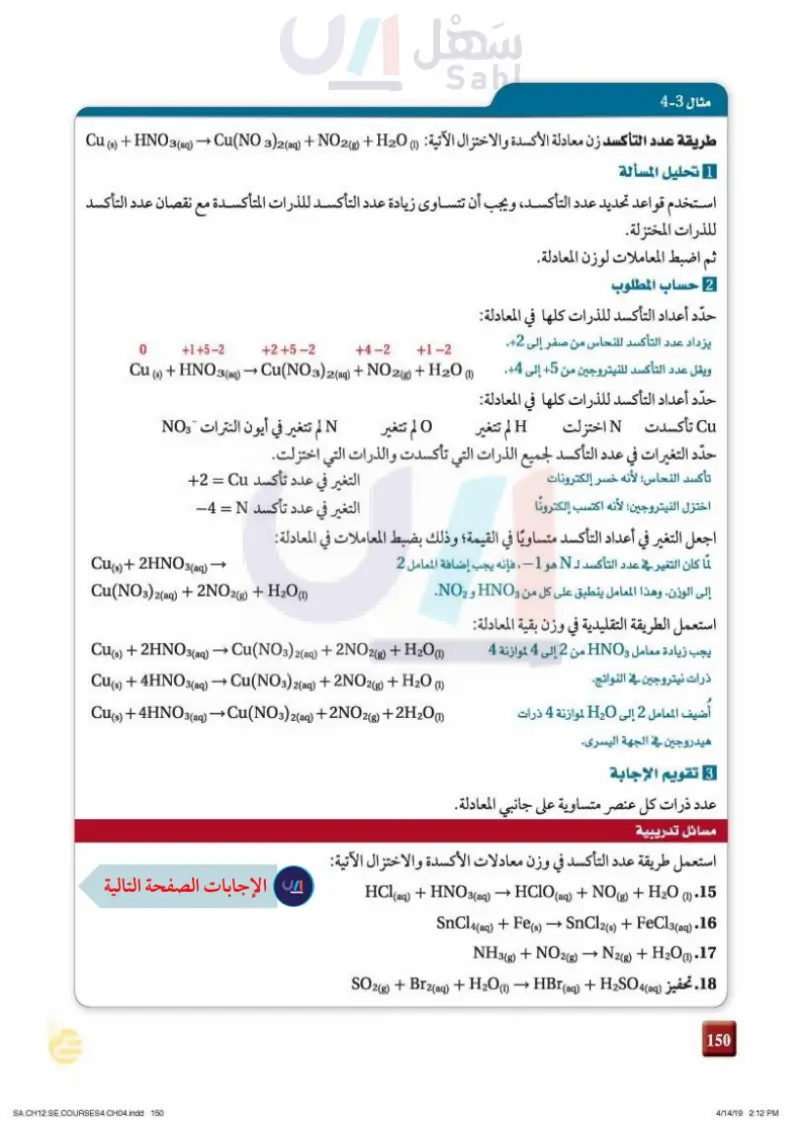
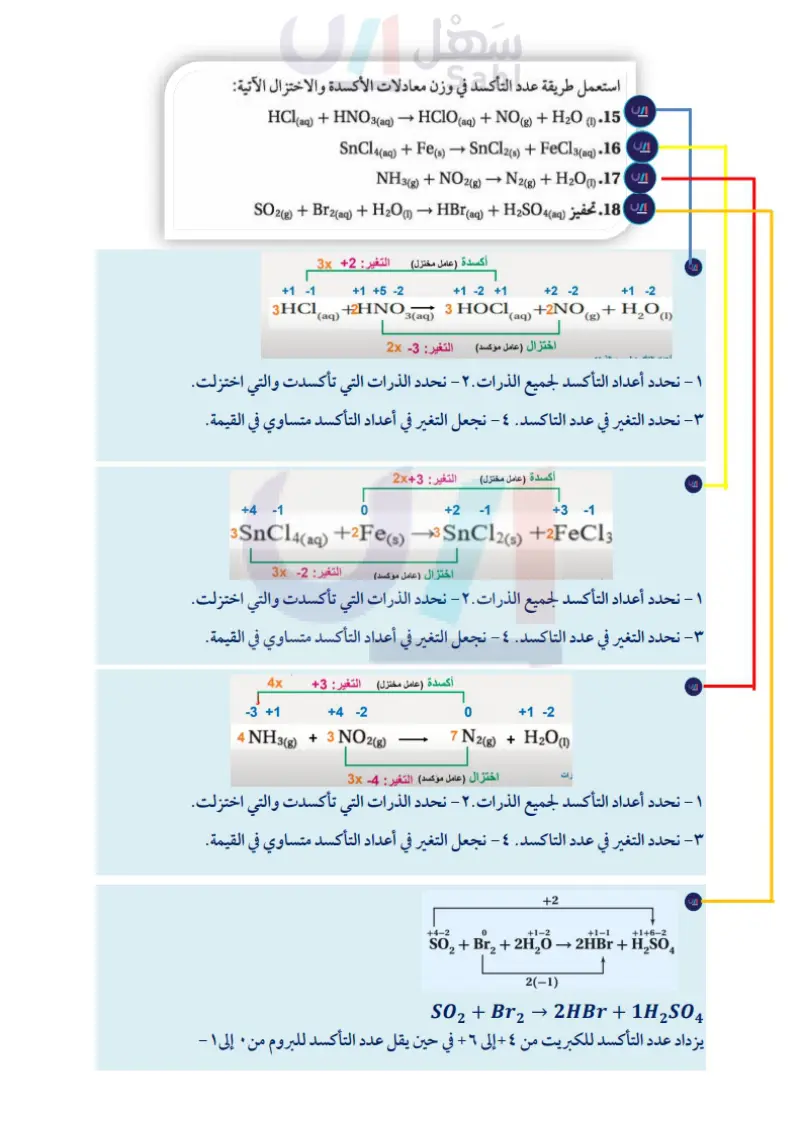
مثال 3-3 طريقة عدد التأكسد زن معادلة الأكسدة والاختزال الآتية : (1) Cu (s) + HNO3(aq) → Cu(NO (3)2(aq) + (g) + H2O 1 تحليل المسألة استخدم قواعد تحديد عدد التأكسد، ويجب أن تتساوى زيادة عدد التأكسد للذرات المتأكسدة مع نقصان عدد التأكسد للذرات المختزلة. ثم اضبط المعاملات لوزن المعادلة. 2 حساب المطلوب حدّد أعداد التأكسد للذرات كلها في المعادلة: 0 +1+5-2 +2+5-2 +4-2 +1-2 Cu (s) + HNO3(aq) → Cu(NO3)2(aq) + NO2(g) + H2O (1) يزداد عدد التأكسد للنحاس من صفر إلى 2. ويقل عدد التأكسد للنيتروجين من +5 إلى 4. حدّد أعداد التأكسد للذرات كلها في المعادلة: Cu تأكسدت N اختزلت H لم تتغير O لم تتغير N لم تتغير في أيون النترات NO3 حدّد التغيرات في عدد التأكسد لجميع الذرات التي تأكسدت والذرات التي اختزلت. تأكسد النحاس؛ لأنه خسر إلكترونات اختزل النيتروجين؛ لأنه اكتسب إلكترونا التغير في عدد تأكسد Cu = 2+ التغير في عدد تأكسد N = 1- اجعل التغير في أعداد التأكسد متساويًا في القيمة؛ وذلك بضبط المعاملات في المعادلة: لما كان التغير في عدد التأكسد لـ N هو 1- ، فإنه يجب إضافة المعامل 2 إلى الوزن. وهذا المعامل ينطبق على كل من HNO3 و NO2. استعمل الطريقة التقليدية في وزن بقية المعادلة: يجب زيادة معامل HNO3 من 2 إلى 4 لموازنة 4 ذرات نيتروجين في النواتج. أضيف المعامل 2 إلى 200 لموازنة 4 ذرات هيدروجين في الجهة اليسرى. Cu(s) + 2HNO3(aq) Cu(NO3)2(aq) + 2NO2(g) + H2O (1) Cu(s) + 2HNO3(aq) → Cu(NO3)2(aq) + 2NO2(g) + H2O(1) Cu(s) + 4HNO3(aq) → Cu(NO3)2(aq) + 2NO2(g) + H2O (1) Cu(s) + 4HNO3(aq) → Cu(NO3)2(aq) + 2NO2(g) + 2H2O (1) وزارة التعليم Ministry of Education 2024-1446 8 تقويم الإجابة عدد ذرات كل عنصر متساوية على جانبي المعادلة. مسائل تدريبية استعمل طريقة عدد التأكسد في وزن معادلات الأكسدة والاختزال الآتية: _ HCl(aq) + HNO3(aq) → HClO (aq) + NO(g) + H2O (1) .15 SnCl4(aq) + Fe(s) → SnCl2(s) + FeCl3(aq).16 NH3(g) + NO2(g) → N2(g) + H2O(1).17 تحفيز SO2(g) + Br2(aq) + H2O(1) → HBr (aq) + H2SO4(aq).18 114

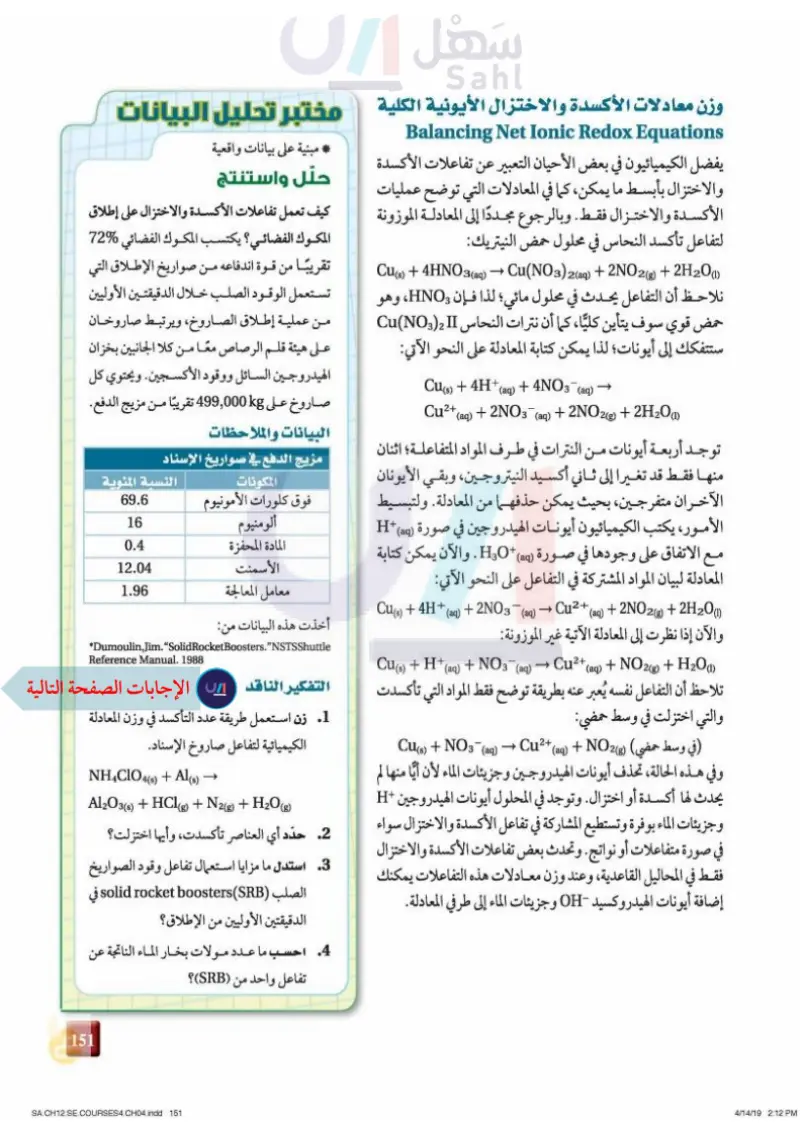
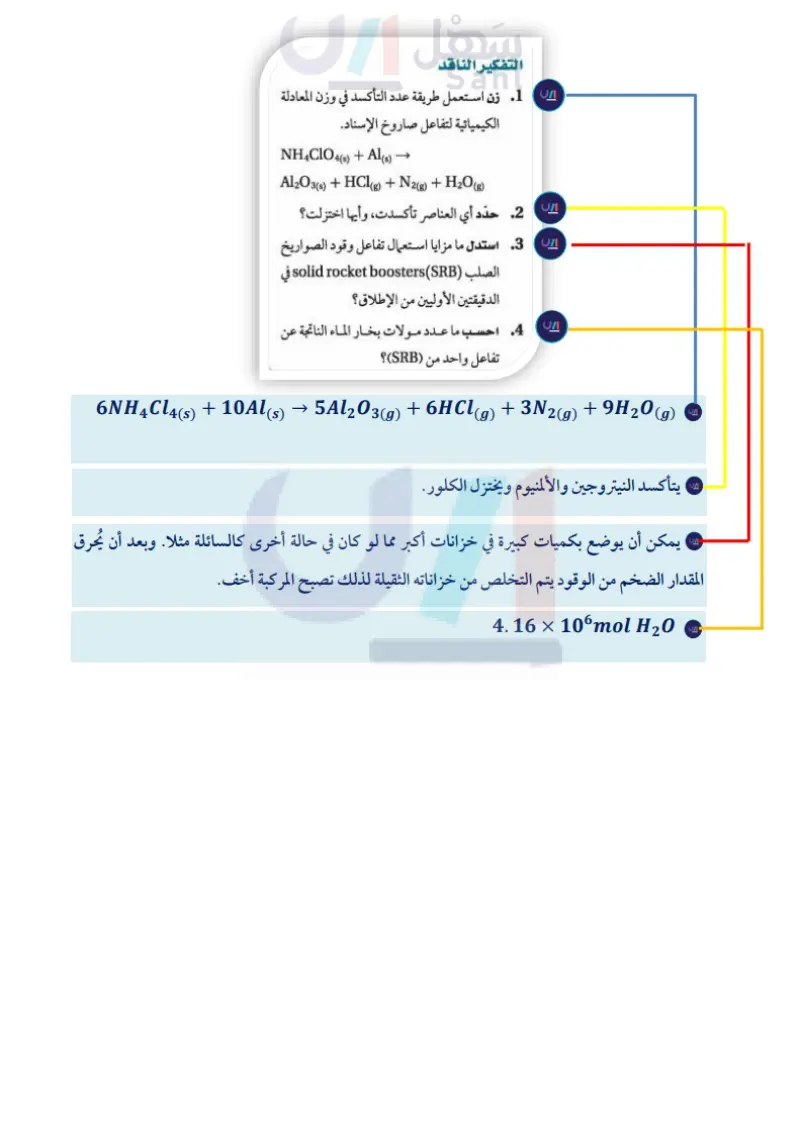
وزن معادلات الأكسدة والاختزال الأيونية الكلية مختبر تحليل البيانات Balancing Net Ionic Redox Equations مبنية على بيانات واقعية يفضل الكيميائيون في بعض الأحيان التعبير عن تفاعلات الأكسدة حلّل واستنتج والاختزال بأبسط ما يمكن كما في المعادلات التي توضح عمليات الأكسدة والاختزال فقط. وبالرجوع مجددًا إلى المعادلة الموزونة كيف تعمل تفاعلات الأكسدة والاختزال على إطلاق المكوك الفضائي؟ يكتسب المكوك الفضائي %72 لتفاعل تأكسد النحاس في محلول حمض النيتريك: Cu(s) + 4HNO3(aq) → Cu(NO3)2(aq) + 2NO2(g) + 2H2O (1) تقريبًا من قوة اندفاعه من صواريخ الإطلاق التي نلاحظ أن التفاعل يحدث في محلول مائي؛ لذا فإن HNO، وهو تستعمل الوقود الصلب خلال الدقيقتين الأوليين حمض قوي سوف يتأين كليًّا، كما أن نترات النحاس Cu(NO) II من عملية إطلاق الصاروخ، ويرتبط صاروخان ستتفكك إلى أيونات؛ لذا يمكن كتابة المعادلة على النحو الآتي: Cu(s) + 4H+ Cu2+ (aq) (aq) + 4NO3-(aq) (aq) + 2NO2(g) + 2H2O(1) + 2NO3- على هيئة قلم الرصاص معًا من كلا الجانبين بخزان الهيدروجين السائل ووقود الأكسجين. ويحتوي كل صاروخ على kg 499,000 تقريبًا من مزيج الدفع. البيانات والملاحظات توجد أربعة أيونات من النترات في طرف المواد المتفاعلة؛ اثنان مزيج الدفع في صواريخ الإسناد منها فقط قد تغيرا إلى ثاني أكسيد النيتروجين، وبقي الأيونان الآخران ،متفرجين، بحيث يمكن حذفهما من المعادلة. ولتبسيط الأمور، يكتب الكيميائيون أيونات الهيدروجين في صورة (H+ (aq مع الاتفاق على وجودها في صورة (HO + (aq . والآن يمكن كتابة المعادلة لبيان المواد المشتركة في التفاعل على النحو الآتي: المكونات فوق كلورات الأمونيوم ألومنيوم المادة المحفزة الأسمنت معامل المعالجة النسبة المئوية 69.6 16 0.4 12.04 1.96 أخذت هذه البيانات من: *Dumoulin,Jim.“SolidRocketBoosters.”NSTSShuttle Reference Manual. 1988 Cu(s) + 4H + (aq) +2NO3(aq) → Cu(s) + H+ (aq) + NOз¯(aq) → Cu2+(aq) + 2NO2(g) + 2H2O(1) والآن إذا نظرت إلى المعادلة الآتية غير الموزونة (aq) → Cu²+ + NO2(g) + H2O(1) تلاحظ أن التفاعل نفسه يُعبر عنه بطريقة توضح فقط المواد التي تأكسدت التفكير الناقد Cu(s) + NO3(aq) → Cu²+ (aq) والتي اختزلت في وسط حمضي (في وسط حمضي) (8)NO2 + وفي هذه الحالة، تحذف أيونات الهيدروجين وجزيئات الماء لأن أيا منها لم يحدث لها أكسدة أو اختزال. وتوجد في المحلول أيونات الهيدروجين +H وجزيئات الماء بوفرة وتستطيع المشاركة في تفاعل الأكسدة والاختزال سواء في صورة متفاعلات أو نواتج وتحدث بعض تفاعلات الأكسدة والاختزال فقط في المحاليل القاعدية، وعند وزن معادلات هذه التفاعلات يمكنك إضافة أيونات الهيدروكسيد OH وجزيئات الماء إلى طرفي المعادلة. • 1 زن استعمل طريقة عدد التأكسد في وزن المعادلة الكيميائية لتفاعل صاروخ الإسناد. NH4ClO4(s) + Al(s) -> - Al2O3 (s) + HCl (g) + N2(g) + H2O(g) 2. حدّد أي العناصر تأكسدت، وأيها اختزلت؟ 3 استدل ما مزايا استعمال تفاعل وقود الصواريخ الصلب (solid rocket boosters (SRB في الدقيقتين الأوليين من الإطلاق؟ 4. احسب ما عدد مولات بخار الماء الناتجة عن تفاعل واحد من (SRB)؟ 115 وزارة ليم Ministry of Education 2024-1446

مثال 4-3 وزن معادلة الأكسدة والاختزال الأيونية الكلية زن معادلة الأكسدة والاختزال الآتية: 1 تحليل المسألة + Br (aq) → Cl (aq) + Br2(g) ClO4 (aq) - استعمل قواعد تحديد عدد التأكسد. يجب أن تتساوى الزيادة في عدد التأكسد للذرات التي تأكسدت مع النقصان في عدد التأكسد للذرات التي اختزلت. يحدث التفاعل في وسط حمضي، اضبط المعاملات لوزن التفاعل. 2 حساب المطلوب حدّد أعداد التأكسد لجميع الذرات في المعادلة. +7-2 −1 -1 0 Br¯(aq) ClO 4 (aq) + Br- ClO4(aq) > CI (aq) استعمل القواعد في الجدول 2-3 ( في الوسط الحمضي) (Br2(g + حدّد الذرات التي اختزلت والذرات التي تأكسدت. ازداد عدد تأكسد البروم من 1- إلى الصفر نقص عدد تأكسد الكلور من 7 إلى 1-. Br تأكسدت CI اختزلت حدّد التغير في عدد التأكسد للذرات التي تأكسدت والذرات التي اختزلت. التغير في عدد التأكسد: ازداد عدد تأكسد البروم من 1 إلى الصفر - نقص عدد تأكسد الكلور من 7 إلى 1 التغير في عدد تأكسد Br = 1+ التغير في عدد تأكسد CI = 8 اجعل التغير في قيم عدد التأكسد متساويًا، وذلك بضبط معاملات المعادلة: بما أن التغير في عدد التأكسد لـ Br هو 1 + ؛ لذا يجب أن تضيف المعامل 8 لوزن المعادلة الكيميائية . 4Br2 تمثل 8 ذرات Br لوزن Br - في الجانب الأيسر. ClO4¯¯(aq) + 8Br¯(aq) → Cl- (aq) + 4Br2(g) أضف عددًا كافيًا من أيونات الهيدروجين وجزيئات الماء إلى المعادلة؛ لوزن ذرات الأكسجين على طرفي المعادلة: بما أنك تعرف أن التفاعل يتم في وسط حمضي، يمكنك إضافة أيونات الهيدروجين H إلى طرفي المعادلة. B تقويم الإجابة ClO4 (aq) + 8Br (aq) +8H+ (aq) Cl (aq) + 4Br2(g) + 4H2O(1) عددا ذرات كل عنصر متساويان في كلا طرفي المعادلة. وكما في المعادلة الأيونية فإن الشحنة الكلية في الطرف الأيمن تساوي الشحنة الكلية في الطرف الأيسر. مسائل تدريبية استعمل طريقة عدد التأكسد في وزن المعادلات الأيونية الكلية الآتية: H2S(g) + NO3 → (aq) S(s) + NO(g) + I2(s) Cr2O (aq) +I(aq) Zn(s) + NO3" (aq) I(aq) +MnO4 (aq) Cr 3+ → Zn²+ -> (aq) (aq) +NO2 (g) 19. (في الوسط الحمضي) 20. (في الوسط الحمضي) 21. (في الوسط الحمضي) 22. تحفيز : ( في الوسط القاعدي) (I2(s) +MnO2(s 116 وزارة التعليم Ministry of Education 2024-1446

الربط علم الأحياء فيم تشترك أسماك أعماق المحيط والذباب الناري مع البكتيريا المضيئة؟ إن هذه الأنواع من الكائنات - وكائنات أخرى ـ تطلق الضوء. والضوء المنبعث ما هو إلا تحويل لطاقة الوضع في الروابط الكيميائية إلى طاقة ضوئية خلال تفاعلات الأكسدة والاختزال. وينبعث الضوء بوسائل مختلفة اعتمادًا على أنواع الكائنات. ففي الذباب الناري الموضح في الشكل 7-3، ينتج الضوء عن تأكسد جزيئات اللوسيفيرن Luciferin . ولا يزال العلماء يكتشفون سر الإضاءة الحيوية؛ فبعض الكائنات المضيئة تطلق الضوء باستمرار، في حين تطلق الكائنات الأخرى ضوءًا عندما تتعرض للمضايقة. ويبدو أن بعض أسماك أعماق البحار وقناديل البحر لها قدرة على التحكم في الضوء الذي تطلقه. وزن معادلة الأكسدة والاختزال باستعمال طريقة نصف التفاعل Balancing Redox Reactions Using Half-Reactions الشكل 7- تُصدر بعض الكائنات الحية ضوء ا لأهداف مختلفة؛ لجذب الإناث، أو للدفاع عن الصغار. المواد في الكيمياء هي أي جسيمات توجد في المعادلة؛ حيث يوجد في معادلة الاتزان ويساعد الضوء المنبعث على الرؤية الآتية: NH3 (aq) +OH- (aq) _ NH(aq) + H2O → Hi (aq) (1) أربعة أنواع من المواد، كتالي جزيئان وهما HO و H ، وأيونان هما +NHو -OH وتحدث تفاعلات الأكسدة والاختزال عندما توجد مواد قادرة على منح الإلكترونات عوامل مختزلة) المواد أخرى قريبة منها، ولها قدرة على كسب هذه الإلكترونات (عوامل مؤكسدة). فعلى سبيل المثال يمكن للحديد أن يختزل أنواعًا عدة من العوامل المؤكسدة، بما فيها الكلور. 2Fe(s)+3Cl2(g) → 2FeCl3(aq) والتمييز والإدراك. تجربة عملية حساب أعداد التأكسد وفي هذا التفاعل تتأكسد كل ذرة حديد بفقدها 3 إلكترونات لتصبح أيون +3 Fe . ارجع إلى دليل التجارب العملية على منصة عين الإثرائية ) وفي الوقت نفسه، فإن كل ذرة كلور في CL تختزل باكتسابها إلكترونًا واحدًا لتصبح أيون CI. الأكسدة : Fe→ Fe3+ +3e الاختزال : 2CI Cl2 +2e- تمثل هذه المعادلات أنصاف تفاعلات؛ حيث يُمثل كل نصف تفاعل أحد جزأي تفاعل الأكسدة والاختزال ؛ أي تفاعل الأكسدة أو تفاعل الاختزال. ويبين الجدول 5-3 التنوع في أنصاف تفاعلات الاختزال التي تتضمن تأكسد Fe إلى +Fe3. الجدول - تفاعلات الأكسدة والاختزال التي يحدث فيها تأكسد الحديد التفاعل الكلي (غير الموزون) نصف تفاعل التأكسد نصف تفاعل الاختزال 117 وزارات ليم Ministry of Education 2024-1446 024e202- F2 + 2e - → F- →2F- 2H+ + 2e → H2 Ag+ + e → Ag → Cu Cu2+ + 2e- Fe → Fe3+ + 3e Fe + O2 Fe2O3 Fe + F2 → FeF Fe HBr → H2 + FeBr3 + Fe + AgNO3 → Ag + Fe(NO3)3 Fe + CuSO4 → Cu + Fe2(SO4)3

أسماك أعماق المحيط والذباب الناري مع البكتيريا المضيئة
تصدر بعض الحيوانات الحية ضوءا لأهداف مختلفة لجذب الإناث أو للدفاع عن الصغار
حساب أعداد التأكسد
الشكل 8-3 يترسب النحاس على الحديد نتيجة لتفاعل الأكسدة والاختزال بين الحديد ومحلول كبريتات النحاس ويمكنك وزن المعادلة الكيميائية لهذا التفاعل بطريقة نصف التفاعل. T 22 من هذا القسم. المطويات سوف تتعلم المزيد عن أهمية أنصاف التفاعلات عند دراستك الكيمياء الكهربائية ضمن مطويتك معلومات لاحقا، ولكن في الوقت الحالي سوف نتعلم كيف تستعمل أنصاف التفاعل لوزن معادلة الأكسدة. فعلى سبيل المثال، تمثل المعادلة غير الموزونة الآتية التفاعل الذي يحدث عند وضع صفيحة من الحديد في محلول كبريتات النحاس II، كما في الشكل 8-3. المفردات المفردات الأكاديمية الطريقة ( Method ) Fe(s) + CuSO4(aq) → Cu(s) + Fe2(SO4)3(aq) تتأكسد ذرات الحديد عندما تفقد الإلكترونات لأيونات النحاس II. أما خطوات آلية لعمل شيء ما. يستعد الطلبة وزن معادلات الأكسدة والاختزال باستخدام طريقة نصف التفاعل فهي موضحة للامتحان بطرائق مختلفة. في الجدول 6-3. الجدول 6-3 طريقة نصف التفاعل .1 اكتب المعادلة الأيونية الكلية للتفاعل، مهملا الأيونات المتفرجة. →> Cu(s) + 2Fe3+ (aq) + 3SO4²¯ (aq) 2. اكتب نصفي تفاعل الأكسدة والاختزال للمعادلة الأيونية الكلية. 2- Fe(s) + Cu2+ (aq) + S042 (aq) → Fe(s) + Cu2+ (aq) -> Cu(aq) + 2Fe3+ (aq) Fe(s) → 2Fe3+ → 2Fe³+ (aq) + 6e- 2Fe(s) →2Fe3+ (aq) +6e- Cu²+(aq) + 2e- →> Cu(s) 3 زن الذرات والشحنات في كل نصف تفاعل. Cu2+ +2e- (aq) → Cu (s) 4. زن المعادلات على أن يكون عدد الإلكترونات المفقودة في التأكسد يساوي عدد الإلكترونات المكتسبة في الاختزال. + 6e¯ → 3Cu(s) 3Cu²+ (aq) 5. اجمع نصفي التفاعل الموزونين، وأعد الأيونات المتفرجة. 2Fe(s) → 2Fe3+ (aq) + 6e- 2Fe(s) + 3Cu2+ 2Fe(s) + 3CuSO4(aq) -> (aq) 3Cu(s) + 2Fe3+ (aq) →> 3Cu(s) + Fe2(SO4)3(aq) 118 وزارة التعليم Ministry of Education 2024-1446

مثال 5-3 وزن معادلة الأكسدة والاختزال باستعمال طريقة نصف التفاعل زن معادلة التأكسد والاختزال للتفاعل الآتي مستعملًا طريقة نصف التفاعل: (في الوسط الحمضي) (MnSO4(aq) + K2SO4(aq → تحليل المسألة KMnO4(aq) + SO2(g) يحدث التفاعل في الوسط الحمضي، استعمل قواعد تحديد أعداد التأكسد وخطوات وزن المعادلة بطريقة نصف التفاعل لوزن معادلة التفاعل بين برمنجنات البوتاسيوم وثاني أكسيد الكبريت. 2 حساب المطلوب اكتب المعادلة الأيونية الكلية للتفاعل. احذف المعاملات، والأيونات المتفرجة. MnO4(aq) + SO2(g) → Mn2+ (aq) + S042 - (aq) اكتب معادلة نصفي تفاعل الأكسدة والاختزال للمعادلة الأيونية الكلية، متضمنة أعداد التأكسد. استخدم القواعد الواردة في الجدولين 2-3 و 6-3 2- →> - SO2 (g) + SO4 (aq) + 2e ( تأكسد ) زن الذرات والشحنات في نصفي التفاعل. تتوافر جزيئات H2O في الوسط الحمضي بكثرة، ويمكن استخدامها في وزن ذرات الأكسجين في أنصاف التفاعل؛ وكذلك تتوافر أيونات * بسهولة ، ويمكن أن تستخدم في وزن الشحنة. Mn04 - (aq) + 5e - + 5e → Mn2+ 2 (aq) . SO2(g) + 2H2O (l) → SO4²¯¯ (aq) + 2e¯ + 4H+ (aq) (Just) (تأكسد) MnO4(aq) +5e+8H+ (aq) Mn2+ →> (aq) + 4H2O(1) (J) اضبط المعاملات على أن يكون عدد الإلكترونات المفقودة في التأكسد (2) يساوي عدد الإلكترونات المكتسبة في الاختزال (5). المضاعف المشترك الاصغر لـ 5 ، 2 هو 10 . وبالضرب التبادلي (تأكسد) – 10e + ستحصل على وزن لنصفي تفاعل التأكسد والاختزال اختزال) H2O + (1) 5SO2(g) + 10H2O(1)→ 5S042 (aq) + 20 H+ 2MnO4¯(aq) + 16H+ (aq) (aq) (aq) + 10e → 2Mn2+ اجمع نصفي التفاعل اللذين تم وزنهما، وبسط المعادلة بحذف أو تجميع المواد المتشابهة في طرفي المعادلة. 5SO 2(g) + 10e – → 5SO (aq) +2MnO4(aq) + 16H + + 10H2O(l) + 2MnO 5SO2(g) + 2H2O(l) + 2MnO4¯¯(aq) →> 5S042- → 5SO2(g) + 2H2O(l) + 2KMnO4(aq) K2SO4(aq) + 2H2SO4(aq) + 2MnSO4(aq) (aq) + 4H+ 2- 5SO 4 2− (aq) + 20 H++(aq) + 10e¯ + 2Mn 2+ (aq) + 2Mn2+ (aq) (aq) + 8H 20 (aq) أعد وضع الأيونات المتفرجة (K)، وكذلك حالات المواد. أضف أيونات K إلى أيونات MnO4 في الجهة اليسرى، وأحد أيونات SO إلى الجهة اليمنى. ثم وزع الأيونات المتبقية بين أيون H+ وأيونات Mn2. 3 تقويم الإجابة تشير مراجعة المعادلة الموزونة إلى أن عدد ذرات كل عنصر هو نفسه في طرفي المعادلة. مسائل تدريبية استعمل طريقة نصف التفاعل لوزن معادلات الأكسدة والاختزال الآتية: 23. ( في الوسط الحمضي) (aq) + (s) Mn2+ (aq) Cr2O (aq) + I (aq) + BiO3(aq) N2O(g) + Clo¯ (aq) → →Cr3+ MnO4-(aq) + Bi3+ 24. ( في الوسط الحمضي) (aq) 25. تحفيز ( في الوسط القاعدي ) (NO2" (aq) + Cl- (aq → 119 وزارت سليم Ministry of Education 2024-1446

استراتيجية حل المسألة وزن معادلات الأكسدة والاختزال هل تظهر المواد التي تأكسدت أو اختزلت حدّد المواد التي تأكسدت والمواد التي اختزلت، وأيها تعد أكثر من مرة في طرفي المعادلة؟ وهل يحدث عوامل مؤكسدة، وأيها تعد عوامل مختزلة؟ التفاعل في وسط حمضي حمضي أم في وسط قاعدي؟ نعم حدد أعداد التأكسد للعناصر كافة. وزن معادلات الأكسدة مع وزن معادلات اكتب المعادلة الأيونية النهائية للمعادلة حذف الأيونات المتفرجة. والاختزال بطريقة عدد اضبط المعاملات في المعادلة، بحيث الأكسدة والاختزال تكون أعداد التأكسد متساوية في القيمة. التأكسد زن بقية المعادلة باستعمال الطريقة التقليدية. طبق الاستراتيجية زن المعادلة الآتية مستعملا المخطط ( في الوسط الحمضي ) (38) + (HPO32-(aq → Pa(s) حدد نصف تفاعل الأكسدة ونصف بطريقة نصف التفاعل تفاعل الاختزال. زن الذرات والشحنات في كل نصف تفاعل. اضبط المعاملات على أن يكون عدد الإلكترونات المفقودة مساويًا لعدد الإلكترونات المكتسبة. اجمع نصفي تفاعل الأكسدة والاختزال، وأعد الأيونات المتفرجة. التقويم 2-3 الخلاصة : 26. الفكرة الرئيسة فسر كيف يرتبط التغير في عدد التأكسد بعمليات الأكسدة والاختزال؟ يصعب وزن معظم معادلات الأكسدة والاختزال باستعمال الطريقة التقليدية. 27. صف لماذا يُعدّ من المهم معرفة الظروف التي يتم فيها تفاعل الأكسدة تعتمد طريقة عدد التأكسد على مساواة والاختزال في المحلول المائي بهدف وزن معادلة التفاعل ؟ عدد الإلكترونات المفقودة من الذرات 28. فسّر خطوات طريقة عدد التأكسد لوزن المعادلة. بعدد الإلكترونات المكتسبة من قبل 29. حدد ماذا يوضح نصف تفاعل التأكسد ؟ وماذا يوضح نصف تفاعل الاختزال؟ ذرات أخرى. 30 . اكتب نصف تفاعل الأكسدة ونصف تفاعل الاختزال لتفاعل الأكسدة لوزن معادلات التفاعلات في الوسط والاختزال الآتي: (Pb(s) + Pd(NO3)2(aq) + (NO)2(a) Pd(s الحمضي، أضف عددًا كافيا من أيونات 31. حدد إذا كان نصف تفاعل الأكسدة هو –Sn4+ + 2e → ونصف تفاعل الاختزال هو Au+ + 3e - Au، فما أقل عدد من أيونات الهيدروجين وجزيئات الماء. Sn2+ أضف عددًا كافيًا من أيونات الهيدروكسيد القصدير II و أيونات الذهب III يمكن أن تتفاعل حتى لا يتبقى إلكترونات ؟ وجزيئات الماء، لوزن معادلات التفاعلات في الوسط القاعدي. نصف التفاعل هو أحد جزأي تفاعل الأكسدة والاختزال. .32. طبق زن المعادلات الآتية: HClO3(aq) H2SeO3(aq) + HClO3(aq) Cr2072- (aq) + Fe2+ (aq) → ClO2(g) + HClO4(aq) + H2O(1) .a → H2SO4(aq) + Cl2(g) + H2O(1) .b (aq) + Fe3+ → Cr3+ (aq) . (في الوسط الحمضي) (aq) 120 وزارة التعليم Ministry of Education 2024-1446

خلاصة درس وزن معادلات الأكسدة والاختزال
ما أقل عدد من أيونات القصدير II وأيونات الذهب III يمكن أن تتفاعل حتى لا يتبقى إلكترونات
طبق زن المعادلات الآتية
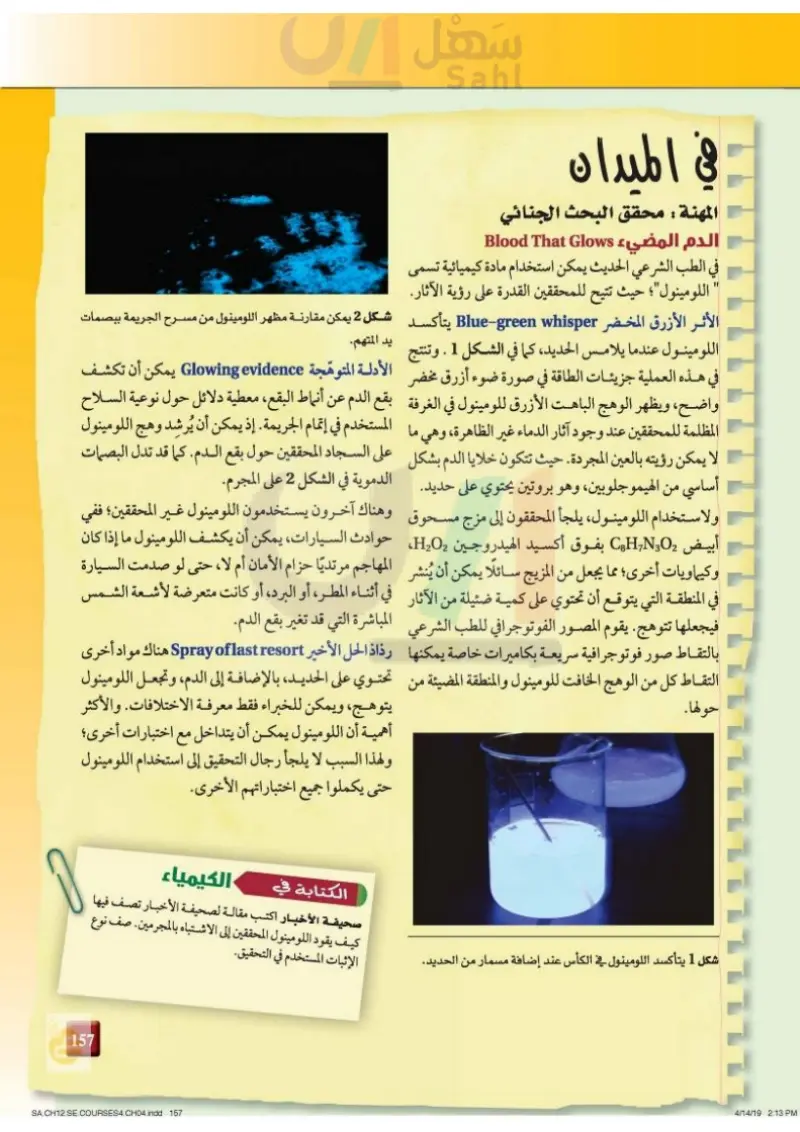
11 11111177 في الميدان المهنة : محقق البحث الجنائي الدم المضيء Blood That Glows في الطب الشرعي الحديث يمكن استخدام مادة كيميائية تسمى " اللومينول"؛ حيث تتيح للمحققين القدرة على رؤية الآثار. الأثر الأزرق المخضر Blue-green whisper يتأكسد شكل 2 يمكن مقارنة مظهر اللومينول من مسرح الجريمة ببصمات يد المتهم. اللومينول عندما يلامس ،الحديد كما في الشكل 1 . وتنتج 6 في هذه العملية جزيئات الطاقة في صورة ضوء أزرق مخضر الأدلة المتوهجة Glowing evidence يمكن أن تكشف واضح، ويظهر الوهج الباهت الأزرق للومينول في الغرفة بقع الدم عن أنماط البقع معطية دلائل حول نوعية السلاح المظلمة للمحققين عند وجود آثار الدماء غير الظاهرة، وهي ما المستخدم في إتمام الجريمة. إذ يمكن أن يُرشد وهج اللومينول لا يمكن رؤيته بالعين المجردة. حيث تتكون خلايا الدم بشكل على السجاد المحققين حول بقع الدم. كما قد تدل البصمات أساسي من الهيموجلوبين، وهو بروتين يحتوي على حديد. الدموية في الشكل 2 على المجرم. ولاستخدام اللومينول، يلجأ المحققون إلى مزج مسحوق وهناك آخرون يستخدمون اللومينول غير المحققين؛ ففي أبيض 02 CHN بفوق أكسيد الهيدروجين H2O2 حوادث السيارات، يمكن أن يكشف اللومينول ما إذا كان وكيماويات أخرى؛ مما يجعل من المزيج سائلا يمكن أن يُنشر المهاجم مرتديًا حزام الأمان أم لا، حتى لو صدمت السيارة في المنطقة التي يتوقع أن تحتوي على كمية ضئيلة من الآثار في أثناء المطر، أو البرد ، أو كانت متعرضة لأشعة الشمس فيجعلها تتوهج . يقوم المصور الفوتوجرافي للطب الشرعي المباشرة التي قد تغير بقع الدم. بالتقاط صور فوتوجرافية سريعة بكاميرات خاصة يمكنها رذاذ الحل الأخير Spray of last resort هناك مواد أخرى التقاط كل من الوهج الخافت للومينول والمنطقة المضيئة من تحتوي على الحديد بالإضافة إلى الدم، وتجعل اللومينول يتوهج، ويمكن للخبراء فقط معرفة الاختلافات والأكثر حولها. أهمية أن اللومينول يمكن أن يتداخل مع اختبارات أخرى؛ ولهذا السبب لا يلجأ رجال التحقيق إلى استخدام اللومينول حتى يكملوا جميع اختباراتهم الأخرى. شكل 1 يتأكسد اللومينول في الكأس عند إضافة مسمار من الحديد. الكتابة في الكيمياء صحيفة الأخبار اكتب مقالة لصحيفة الأخبار تصف فيها كيف يقود اللومينول المحققين إلى الاشتباه بالمجرمين. صف نوع الإثبات المستخدم في التحقيق. 121 وزار سليم Ministry of Education 2024-1446

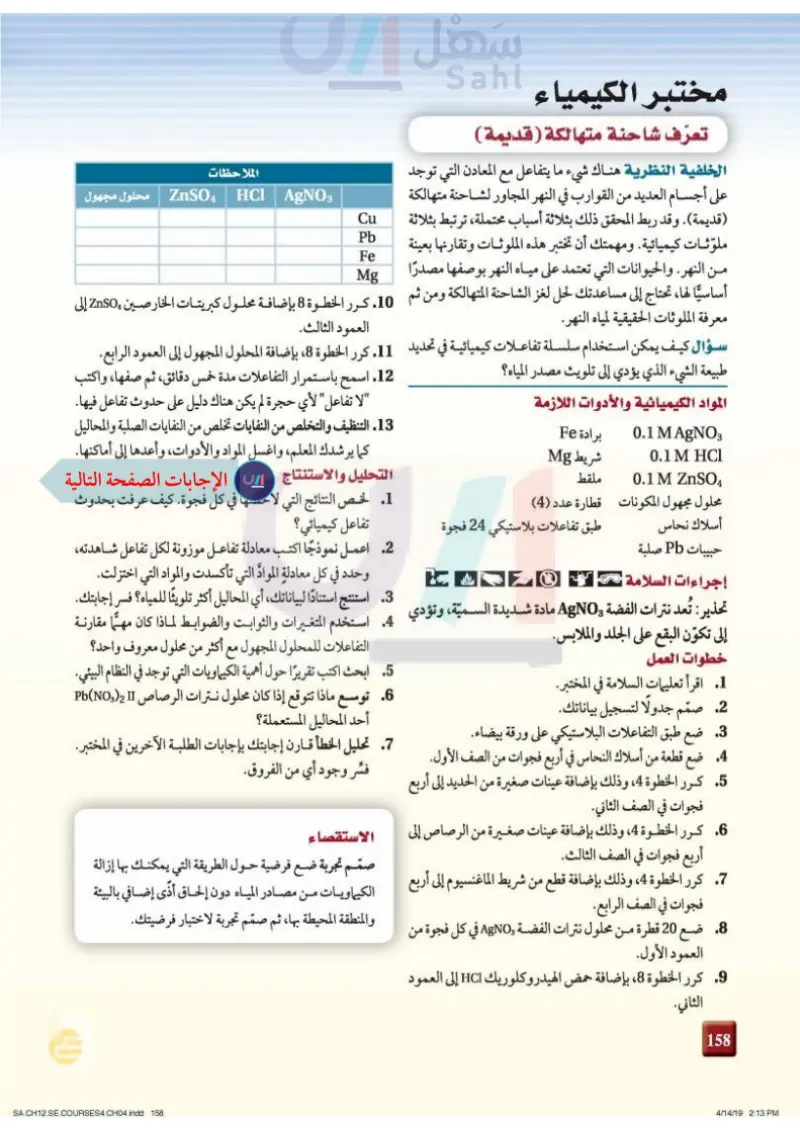
مختبر الكيمياء تعرف شاحنة متهالكة ( قديمة ) الخلفية النظرية هناك شيء ما يتفاعل مع المعادن التي توجد على أجسام العديد من القوارب في النهر المجاور لشاحنة متهالكة (قديمة). وقد ربط المحقق ذلك بثلاثة أسباب محتملة، ترتبط بثلاثة ملوّثات كيميائية. ومهمتك أن تختبر هذه الملوثات وتقارنها بعينة من النهر. والحيوانات التي تعتمد على مياه النهر بوصفها مصدرًا الملاحظات HCI | AgNO3 Cu Pb Fe Mg ZnSO4 محلول مجهول أساسيا لها، تحتاج إلى مساعدتك لحل لغز الشاحنة المتهالكة ومن ثم 10. كرر الخطوة 8 بإضافة محلول كبريتات الخارصين ZnSO إلى معرفة الملوثات الحقيقية لمياه النهر. العمود الثالث. سؤال كيف يمكن استخدام سلسلة تفاعلات كيميائية في تحديد 11. كرر الخطوة 8، بإضافة المحلول المجهول إلى العمود الرابع. طبيعة الشيء الذي يؤدي إلى تلويث مصدر المياه؟ المواد الكيميائية والأدوات اللازمة 0.1 M AgNO3 0.1 M HCl 0.1 M ZnSO برادة Fe شريط Mg ملقط محلول مجهول المكونات قطارة عدد (4) أسلاك نحاس حبيبات Pb صلبة إجراءات السلامة 3 طبق تفاعلات بلاستيكي 24 فجوة 12. اسمح باستمرار التفاعلات مدة خمس دقائق، ثم صفها، واكتب "لا تفاعل" لأي حجرة لم يكن هناك دليل على حدوث تفاعل فيها. 13. التنظيف والتخلص من النفايات تخلص من النفايات الصلبة والمحاليل كما يرشدك المعلم، واغسل المواد والأدوات، وأعدها إلى أماكنها. التحليل والاستنتاج 1. لخص النتائج التي لاحظتها في كل فجوة. كيف عرفت بحدوث تفاعل كيميائي؟ 2 اعمل نموذجًا اكتب معادلة تفاعل موزونة لكل تفاعل شاهدته، وحدد في كل معادلة المواد التي تأكسدت والمواد التي اختزلت. 3 استنتج استنادًا لبياناتك، أي المحاليل أكثر تلويئًا للمياه؟ فسر إجابتك. تحذير : تُعد نترات الفضة AgNO مادة شديدة السمية، وتؤدي 4. استخدم المتغيرات والثوابت والضوابط لماذا كان مهـــا مقارنة إلى تكوّن البقع على الجلد والملابس. خطوات العمل 1. اقرأ تعليمات السلامة في المختبر. 2. صمّم جدولا لتسجيل بياناتك. . ضع طبق التفاعلات البلاستيكي على ورقة بيضاء. .4 ضع قطعة من أسلاك النحاس في أربع فجوات من الصف الأول. 5. كرر الخطوة ،4 وذلك بإضافة عينات صغيرة من الحديد إلى أربع ، فجوات في الصف الثاني. 6. كرر الخطوة 4، وذلك بإضافة عينات صغيرة من الرصاص إلى أربع فجوات في الصف الثالث. 7. كرر الخطوة ،4 ، وذلك بإضافة قطع من شريط الماغنسيوم إلى أربع فجوات في الصف الرابع. 8. ضع 20 قطرة من محلول نترات الفضة AgNO في كل فجوة من العمود الأول. 9. كرر الخطوة ،8، بإضافة حمض الهيدروكلوريك HCI إلى العمود التفاعلات للمحلول المجهول مع أكثر من محلول معروف واحد؟ 5. ابحث اكتب تقريرًا حول أهمية الكيماويات التي توجد في النظام البيئي. 6 توسع ماذا تتوقع إذا كان محلول نترات الرصاص NO) II) أحد المحاليل المستعملة؟ .7 تحليل الخطأ قارن إجابتك بإجابات الطلبة الآخرين في المختبر. فسّر وجود أي من الفروق. الاستقصاء صمم تجربة ضع فرضية حول الطريقة التي يمكنك بها إزالة الكيماويات من مصادر المياه دون إلحاق أذًى إضافي بالبيئة والمنطقة المحيطة بها، ثم صمّم تجربة لاختبار فرضيتك. 122 الثاني. وزارة التعليم Ministry of Education 2024-1446

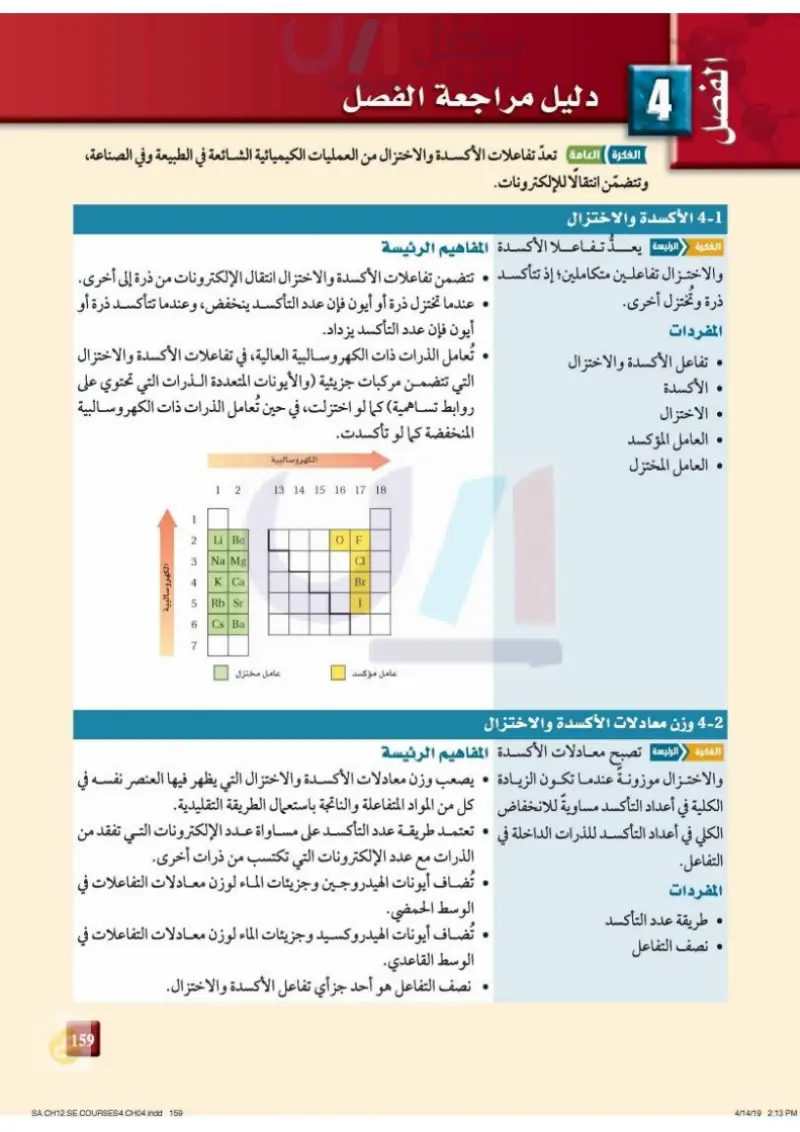
• 3 دليل مراجعة الفصل الفكرة ( العامة تعدّ تفاعلات الأكسدة والاختزال من العمليات الكيميائية الشائعة في الطبيعة وفي الصناعة، وتتضمن انتقالًا للإلكترونات. 3-1 الأكسدة والاختزال الفكرة الرئيسة بعد تفاعلا الأكسدة المفاهيم الرئيسة ذرة وتختزل أخرى. المفردات والاختزال تفاعلين متكاملين؛ إذ تتأكسد . تتضمن تفاعلات الأكسدة والاختزال انتقال الإلكترونات من ذرة إلى أخرى. عندما تختزل ذرة أو أيون فإن عدد التأكسد ينخفض، وعندما تتأكسد ذرة أو أيون فإن عدد التأكسد يزداد. تعامل الذرات ذات الكهروسالبية العالية، في تفاعلات الأكسدة والاختزال التي تتضمن مركبات جزيئية ( والأيونات المتعددة الذرات التي تحتوي على روابط تساهمية) كما لو اختزلت، في حين تُعامل الذرات ذات الكهروسالبية المنخفضة كما لو تأكسدت. تفاعل الأكسدة والاختزال الأكسدة . الاختزال . العامل المؤكسد العامل المختزل الكهروسالبية 1 2 13 14 15 16 17 18 1 2 Li Be OF 3 Na Mg Cl الله 4 K Ca Br LO Rb Sr 1 6 Cs Ba له 7 عامل مؤكسد عامل مختزل الكهروسالبية . 2- وزن معادلات الأكسدة والاختزال الفكرة الرئيسة | تصبح معادلات الأكسدة المفاهيم الرئيسة والاختزال موزونة عندما تكون الزيادة . يصعب وزن معادلات الأكسدة والاختزال التي يظهر فيها العنصر نفسه في الكلية في أعداد التأكسد مساويةً للانخفاض كل من المواد المتفاعلة والناتجة باستعمال الطريقة التقليدية. الكلي في أعداد التأكسد للذرات الداخلة في تعتمد طريقة عدد التأكسد على مساواة عدد الإلكترونات التي تفقد من الذرات مع عدد الإلكترونات التي تكتسب من ذرات أخرى. التفاعل. المفردات طريقة عدد التأكسد نصف التفاعل تُضاف أيونات الهيدروجين وجزيئات الماء لوزن معادلات التفاعلات في الوسط الحمضي. تُضاف أيونات الهيدروكسيد وجزيئات الماء لوزن معادلات التفاعلات في الوسط القاعدي. نصف التفاعل هو أحد جزأي تفاعل الأكسدة والاختزال. 123 وزارات ليم Ministry of Education 2024-1446

تعد تفاعلات الأكسدة والاختزال من العمليات الكيميائية الشائعة في الطبيعة وفي الصناعة وتتضمن انتقالا للإلكترونات
3 التقويم 33 إتقان المفاهيم 3-1 33. ما أهم خواص تفاعلات الأكسدة والاختزال؟ 34. فسر ، لماذا لا تتضمن جميع تفاعلات الأكسدة الأكسجين؟ 35. ماذا يحدث للإلكترونات في الذرة عندما تتأكسد، أو تختزل؟ 36. عرّف عدد التأكسد. 37. ما عدد التأكسد لكل من الفلزات القلوية الأرضية والفلزات القلوية في مركباتها ؟ إتقان حل المسائل 41. حدّد المواد التي تأكسدت والتي اختزلت في معادلات الأكسدة والاختزال الآتية: 2Br2(1) 2Ga(s) → 2GaBrз(s) .a 2HCl(aq) + Zn(s) → ZnCl2(g) + H2(g) .b + 3Mg(s) N2 (g) → Mg3N2(s) .c 42. حدّد العامل المؤكسد والعامل المختزل في كل من معادلات الأكسدة والاختزال الآتية: N2(g) + 3H2(g) → 2NH3(g) .a 2Na(s) + I2(s) 2Nal (s) .b 38. كيف يرتبط عدد التأكسد في عمليات التأكسد بعدد 43. ما العامل المختزل في المعادلة الموزونة الآتية ؟ a الإلكترونات المفقودة؟ وكيف يرتبط عدد التأكسد في عمليات الاختزال بعدد الإلكترونات المكتسبة ؟ b 8H* (aq) + Sn(s)+ 6Cl¯(aq) + 4NO3¯(aq) SnCl2(aq)+4NO2(g) + 4H2O(1) 44. ما عدد التأكسد للمنجنيز في KMnO؟ 4 45. حدّد عدد التأكسد للعنصر الظاهر باللون الداكن في المواد والأيونات الآتية: NO2 BrO3 .d .C CaCrO4 .a NaHSO4 .b الشكل 9-3 39. ما سبب الاختلاف في أشكال خراطة النحاس الموضحة 46. حدّد أي أنصاف التفاعلات الآتية أكسدة، وأيها اختزال؟ في الشكل 9-3؟ 40. النحاس والهواء تبدأ أواني النحاس في الظهور بلون (aq)+3e¯ .a .b Cu2+ Al(s)→ Al3+ (aq) +e-. → Cu+ (aq) أخضر بعد تعرضها للهواء. ويتفاعل فلز النحاس في 47. أي المعادلات الآتية لا تمثل تفاعل أكسدة واختزال؟ فسر عملية الأكسدة هذه مع الأكسجين لتكوين أكسيد النحاس الصلب، والذي يكوّن الغطاء الأخضر. اكتب تفاعل الأكسدة والاختزال، وعرّف ما الذي تأكسد، وما الذي اختزل في هذه العملية. إجابتك. .a +H₂O (1) +HNO3(aq) →LINO3 (s) LiOH(s) MgI2 (s) +Br2 (1) → MgBr2 (s) +12 (s) .b 48. حدّد عدد التأكسد للنيتروجين في كل من الجزيئات أو الأيونات الآتية: وزارة التعليم Ministry of Education 2024-1446 NF3 .c NO .b NO 3 .a 124

أي المعادلات الآتية لا تمثل تفاعل أكسدة واختزال فسر إجابتك
حدد عدد التأكسد للنيتروجين في كل من الجزيئات أو الأيونات الآتية
ما سبب الاختلاف في أشكال خراطة النحاس
لماذا لا تتضمن جميع تفاعلات الأكسدة الأكسجين
ماذا يحدث للإلكترونات في الذرة عندما تتأكسد أو تختزل
عرف عدد التأكسد
ما عدد التأكسد لكل من الفلزات القلوية الأرضية والفلزات القلوية في مركباتها
تقويم الفصل 3 49. حدّد أعداد التأكسد لكل عنصر في المركبات أو الأيونات 58. صف ما يحدث للإلكترونات في كل نصف تفاعل من الآتية: Aur Sea سيلينات الذهب III . (Ni(CN سيانيد النيكل II .b SO عملية الأكسدة والاختزال. إتقان حل المسائل 59. استعمل طريقة عدد التأكسد لوزن معادلات الأكسدة والاختزال الآتية: الشكل 10-3 2- ثالث عن 50. فسّر كيف يختلف أيون الكبريتيت SO أكسيد الكبريت S03 ، الموضح في الشكل 10-3؟ 3-2 NaCl(s)+HOCl(aq) .a Cl2(g) +NaOH(aq) → NaCl(s) +HOCl(aq) HBrO3 (g) → Br2 (1) +H2O(1) +O2(g) .b 60. زن المعادلات الأيونية الكلية لتفاعلات الأكسدة والاختزال الآتية: Ce4+ Au(s)+I2(s) .a Au3+ (aq) + I (aq) .b Ce3+ (aq)+Sn4+ (aq) → (aq) (aq)+Sn2+ →> 61. استخدم طريقة عدد التأكسد لوزن معادلات الأكسدة والاختزال الأيونية الآتية: Al + I2 → Al3*+ I a إتقان المفاهيم MnOz+Br → . ( في الوسط الحمضي) Mn+Br2 → 51. قارن بين معادلة الأكسدة والاختزال الموزونة في الوسط 62. استعمل طريقة عدد التأكسد لوزن معادلات الأكسدة الحمضي والوسط القاعدي. 52. فسر لماذا تعد كتابة أيون الهيدروجين على هيئة +H في تفاعلات الأكسدة والاختزال تبسيطا للواقع. 53. لماذا يتعين عليك قبل أن تبدأ بوزن معادلة تفاعل الأكسدة والاختزال معرفة ما إذا كان التفاعل يحدث في وسط حمضي أو قاعدي؟ 54. فسر ما الأيون المتفرج؟ 55. عرّف مصطلح أنواع المواد بدلالة تفاعلات الأكسدة والاختزال. 56. هل المعادلة الآتية موزونة؟ فسر إجابتك. Fe(s)+Ag+ (aq) → Fe²+ (aq)+Ag(s) والاختزال الآتية: 4 .b PbS(s) + O2(g) → PbO (s) + SO2 (g) .a NaWO3(s) + NaOH(s) + 02(g) + NazWO + H2O (8) NH3 (g) + CuO (s) → CU(s) +N2 (g) + H2O (g) .c Al2O3 (s) + C(s)+Cl2(g) → AlCl3 (s) + CO (g) .d الشكل 11-3 63. الياقوت يتكون معدن الكورنديوم من أكسيد الألومنيوم Al2O3 وهو عديم اللون، ويعد أكسيد الألومنيوم المكون الرئيس للياقوت، إلا أنه يحتوي على مقادير بسيطة 57. هل المعادلة الآتية تمثل عملية أكسدة أم عملية اختزال؟ ن +Fe2 و Tit . ويعزى لون الياقوت إلى انتقال فسّر إجابتك. الإلكترونات من 2 إلى Ti4. استنادًا إلى الشكل +2e → Zn (s) Zn2+ (aq) 3-11، استنتج التفاعل الذي يحدث لينتج المعدن في الجهة اليمنى، وحدد العامل المؤكسد، والعامل المختزل. 125 وزارة ليم Ministry of Education 2024-1446

استنادا إلى الشكل 3-11 استنتج التفاعل الذي يحدث لينتج المعدن في الجهة اليمنى وحدد العامل المؤكسد، والعامل المختزل
استخدم طريقة عدد التأكـد لوزن معادلات الأكسدة والاختزال الأيونية الآتية
زن المعادلات الأيونية الكلية لتفاعلات الأكسدة والاختزال الآتية
عرف مصطلح أنواع المواد بدلالة تفاعلات الأكسدة والاختزال
هل المعادلة الآتية موزونة فسر إجابتك
هل المعادلة الآتية تمثل عملية أكسدة أم عملية اختزال فسر إجابتك
فسر لماذا تعد كتابة أيون الهيدروجين على هيئة +H في تفاعلات الأكسدة والاختزال تبسيطا للواقع
لماذا يتعين عليك قبل أن تبدأ بوزن معادلة تفاعل الأكسدة والاختزال معرفة ما إذا كان التفاعل يحدث في وسط حمضي أو قاعدي
فسر كيف يختلف أيون الكبريتيت عن ثالث أكسيد الكبريت
تقويم الفصل 3 64. اكتب نصفي تفاعل الأكسدة والاختزال في كل من 69. استعمل طريقة نصف التفاعل لوزن معادلات تفاعلات معادلات الأكسدة والاختزال الآتية على الصورة الأيونية الأكسدة والاختزال الآتية، مضيفًا جزيئات الماء إذا حدث في المحلول المائي: PbO(s)+NH3(g) →> N2(g) + H2O(1)+Pb .a I2(s)+Na2S2O3(aq) → Na2S2O4(aq) +Nal .b Sn(s)+HCl(aq) → SnCl2(aq)+H2(g) .C 65. اكتب نصفي التفاعل اللذين يكونان معادلة الأكسدة والاختزال الموزونة الآتية: 3H2C2O4 (1) + 2HASO2 (aq) → 6CO2 (g) +2AS (s) + 4H2O (1) 66. أي أنصاف التفاعلات الآتية أكسدة، وأيها اختزال؟ وأيونات الهيدروجين (في الوسط الحمضي)، أو أيونات الهيدروكسيد ( في الوسط القاعدي) إذا تطلب الأمر ذلك : NH3(g) + NO2(g) → N2(g) + H2O(1) .a → Br (aq) + BrO3 (aq) .b (1) Br2 في الوسط القاعدي) 70. زن معادلة التأكسد والاختزال الآتية، وأعد كتابتها بشكلها الأيوني الكامل ، ثم اشتق المعادلة الأيونية الكلية، وزنها بطريقة نصف التفاعل. على أن تكون الإجابة النهائية بمعاملات الوزن ولكن على النحو الآتي: KMnO4(aq) +FeSO4(aq) + H2SO4(aq) Fe2(SO4)3(aq)+MnSO4(aq)+K2SO4(aq) +H2O(1) 71. استخدم طريقة عدد التأكسد في وزن معادلات الأكسدة والاختزال الآتية: PbO (s) + NH3(g) → N2(g) + H2O(1) + Pb(s) .a I2(s) + Na2S2O3(aq) → Na2S2O4(aq) + NaI(aq) .b Sn(s) + HCl(aq) → SnCl2(aq) +H2(g) .c Mn04 4 (aq) Fe2+ + 5e" + 8H (aq) 2H+ (aq) → Fe³+ (aq) + e¯ → Mn²+ (aq) + 4H2O (1) F2(g) .a .b (aq) → +2e- H2(g) .c + 2e.d → 2F (aq) الشكل 12-3 72. استخدم طريقة نصف التفاعل في وزن هذه المعادلات مضيفًا جزيئات الماء وأيونات الهيدروجين (في الوسط 67. النحاس عندما توضع شرائح النحاس في محلول نترات الحمضي)، أو أيونات الهيدروكسيد (في الوسط القاعدي) الفضة كما في الشكل 12-3 يبدو فلز الفضة أزرق اللون، وتتكون نترات النحاس II اكتب المعادلة الكيميائية غير الموزونة، ثم حدد حالة التأكسد لكل عنصر فيها. اكتب أيضًا نصفي معادلة التفاعل، وحدّد أيهما تأكسد، وأيهما اختزل. وأخيرًا اكتب المعادلة الكيميائية الموزونة للتفاعل. عند الحاجة. واحتفظ بالمعادلات الموزونة في صورة معادلة أيونية نهائية: .a .b .(s) Cl(aq) + NO3(aq) → ClO (aq) (في الوسط الحمضي) IO3 (aq) + Br (aq) (في الوسط الحمضي) + NO(g) → Br₂(1) + IBr 12(s)+Na2S2O3(aq) →Na2S2O4(aq)+NaI(aq) .c MoCl5(s) + S2- 2- (aq) TiCl (aq) + Zn .(s) →> , MoS2 (s) + Cl (aq) Ti3+ (aq) + CI (aq) (aq) + (s) a + Zn2+ (aq) 68. استخدم طريقة عدد التأكسد لوزن معادلات الأكسدة والاختزال الأيونية الآتية: (في الوسط الحمضي) وزارة التعليم Ministry of Education 2024-1446 126

اكتــب نصفي تفاعل الأكسدة والاختزال في كل من معادلات الأكسدة والاختزال الآتية على الصورة الأيونية إذا حدث في المحلول المائي

استعمل طريقة نصف التفاعل لوزن معادلات تفاعلات الأكسدة والاختزال الآتية مضيفا جزيئــات الماء وأيونات الهيدروجين

استخدم طريقة نصف التفاعل في وزن هذه المعادلات مضيفا جزيئات الماء وأيونات الهيدروجين (في الوسط الحمضي) أو أيونات الهيدروكسيد (في الوسط القاعدي)
زن معادلة التأكسد والاختزال الآتية وأعد كتابتها بشكلها الأيوني الكامل ثم اشتق المعادلة الأيونية الكلية وزنها بطريقة نصف التفاعل
اكتب المعادلة الكيميائية غير الموزونة، ثم حدد حالة التأكسد لكل عنصر فيها اكتب أيضا نصفي معادلة التفاعل وحدد أيهما تأكســد وأيهما اختزل
استخدم طريقة عدد التأكسد لوزن معادلات الأكسدة والاختزال الأيونية الآتية
اكتب نصفي التفاعل اللذين يكونان معادلة الأكسدة والاختزال الموزونة الآتية
3 تقويم الفصل مراجعة عامة 73. حدّد عدد التأكسد لكل عنصر من العناصر الظاهرة بلون 78. ما عدد تأكسد الكروم في كل من المركبات الموضحة في a الشكل 13-3؟ (b K2Cr2O7 الشكل 13-3 K2CrO4 داکن Fe2O3 .d RuO4 .c UO22+ .b OF₂ .a 74 . حدّد كلًّا من التغيرات الآتية إذا كانت أكسدة أو اختزال: 2Cl(aq) → Cl2(g) + 2e¯ .a +e .b Na(s) → Na+(aq) + e Ca2+ → + 2e- (aq) Ca(s) O2(g) + 4e-20²- (aq) →202(aq) .C .d 79. زن معادلات الأكسدة والاختزال الأيونية الآتية بأي طريقة من طرائق وزن المعادلات. 75. استعمل قواعد تحديد عدد التأكسد لإكمال الجدول 7-3. الجدول 7 - 3 بيانات المركبين العنصر عدد التأكسد القاعدة .a .b + MnO4(aq) Sb 3+ (aq) →SbO43- (aq) + Mn2+ (aq) (في الوسط الحمضي) N2O(g) + ClO - (aq) Cl (aq) + NO2 (aq) K in KBr Br in KBr Cl in Cla K in KCl +1 8 1 7 −1 Cl in KCl 0 Br in Br2 76. حدد العوامل المختزلة في المعادلات الآتية: .a 4NH3(g) +502(g) → 4NO(g) + 6H2O (1) Na2SO4(aq) + 4C(s) + Na2S(s) + 4C0 (g) .b 4CO(g) 4IrF5(aq) + Ir(s) → 5IrF4 (s) .c (في الوسط القاعدي) 80 الأحجار الكريمة الياقوت حجر كريم يتكون من أكسيد الألومنيوم، أما لونه الأحمر فقد جاء من احتوائه على مقادير ضئيلة من أيونات الكروم III التي تحل محل أيونات الألومنيوم ارسم تركيب أكسيد الألومنيوم، ووضح التفاعل الذي تحل فيه أيونات الكروم محل أيونات الألومنيوم. هل هذا التفاعل تفاعل تأكسد واختزال؟ 81 زن معادلات الأكسدة والاختزال الأيونية الآتية بأي طريقة من طرائق الوزن 77. اكتب معادلة أيونية موزونة مستعملا أزواج أنصاف Mg(s) + Fe3+ (aq) → Mg2+ (aq) + Fe(s) a 2- ( في الوسط الحمضي) (aq) +SO4 (aq) ClO3 - (aq) +SO2(g) →CI .82 زن معادلات الأكسدة والاختزال الآتية بأي طريقة من طرائق الوزن: P(s) + H2O (1) + HNO3(aq) → H3PO4(aq) + NO (g) .a KClO 3(aq) + HCl KClO3(aq) (aq) → Cl2(g) + ClO2(g) .b + H2O(1) + KCl (s) Fe(s) + Fe2+ (aq) تفاعلات الأكسدة والاختزال الآتية: +2e- +2e → Te(s) Te2+ (aq) + 2e - I04 Al (s) (aq) + 2e → 103 (aq) (aq) + 3e - → Al3+ 12(aq) + 2e21– (aq) N2O(g) →> 2NO3¯(aq) (في الوسط الحمضي) ( في الوسط القاعدي) - 8e + .a .b .c 127 وزار سليم Ministry of Education 2024-1446

ارسم تركيب أكسيد الألومنيوم ووضح التفاعل الذي تحل فيه أيونات الكروم محل أيونات الألومنيوم. هل هذا التفاعل تفاعل تأكسد واختزال

زن معادلات الأكسدة والاختزال الآتية بأي طريقة من طرائق الوزن
زن معادلات الأكسدة والاختزال الأيونية الآتية بأي طريقة من طرائق وزن المعادلات
اكتب معادلة أيونية موزونة مستعملا أزواج أنصاف تفاعلات الأكسدة والاختزال الآتية
حدد كلا من التغيرات الآتية إذا كانت أكسدة أو اختزال
ستعمل قواعد تحديد عدد التأكسد لإكمال الجدول .3-7
تقويم الفصل 3 التفكير الناقد 86 جد الحل تؤكسد بر منجنات البوتاسيوم أيونات الكلوريد .83 طبق تبين المعادلات الآتية تفاعلات الأكسدة والاختزال لتكون غاز الكلور وأيون منجنيز Mn2. +Mn2. قم بموازنة التي تستخدم لتحضير غاز النيتروجين النقي وغاز ثاني أكسيد معادلة تفاعل التأكسد والاختزال الذي يحدث في الوسط النيتروجين وغاز أول أكسيد النيتروجين NO في المختبر : NH4NO2(s) → N2(g) + 2H2O(1) → N2O(g) + 2H2O(1) NH4NO 3(s) الحمضي. + 87 في نصف التفاعل NO → NH، في أي الطرفين يجب إضافة الإلكترونات؟ قم بإضافة العدد الصحيح a حدّد عدد التأكسد لكل عنصر في المعادلتين، ثم من الإلكترونات للطرف الذي يحتاج إلى لذلك، ثم أعد كتابة المعادلة. ارسم مخططًا توضح فيه التغير في عدد التأكسد الذي يحدث في كل تفاعل. b. حدّد الذرة التي تأكسدت والذرة التي اختزلت في كلا التفاعلين. حدّد العامل المؤكسد والعامل المختزل لكلا التفاعلين. d اكتب جملة توضح فيها كيفية انتقال الإلكترونات الذي حدث في هذين التفاعلين عن التفاعل الآتي: Zn(NO3)2(aq) + 2Ag (s) 2AgNO3(aq) + Zn (s) الشكل 15-3 88. استعمل طريقة نصف التفاعل لوزن معادلة تفاعل الأكسدة والاختزال الذي يحدث بين أيونات الدايكرومات وأيونات اليوديد في الوسط الحمضي، والذي يوضحه الشكل .15 أيون رابع ثيونات (SO) أيون الثيوكبريتات (SO) مسألة تحفيز الشكل 14-3 .84 حلل ادرس المعادلة الأيونية الكلية أدناه، للتفاعل الذي يحدث عند تأكسد أيون الثيوكبريتات SO2 إلى أيون 89 اكتب المعادلة الكيميائية لكل تفاعل موصوف فيما يأتي دون كتابة المعاملات ،لوزنها، ثم حدد حالة التأكسد لكل عنصر في المعادلة. ثم اكتب نصفي التفاعل محددًا رابع ثيونات SO. زن المعادلة مستعملًا طريقة 6 نصف التفاعل. وسوف يساعدك الشكل 14-3 على تحديد أعداد التأكسد لاستعمالها. S2032- + I2(s) → I¯(aq) S2O3² (aq) + I2(s) ( في الوسط الحمضي) (S4062- (aq + 85 توقع اعتبر أن جميع المركبات الآتية مركبات مستقرة حقيقة. ما الذي يمكنك أن تستدل عليه عن التأكسد للفوسفور في مركباته؟ PH3, PCl3, P2H4, PCl5, H3PO4, Na3 PO3 حالة .a أيهما نصف تفاعل أكسدة وأيهما نصف تفاعل اختزال. عند وضع أكسيد الزئبق (II) الصلب في أنبوب وتسخينه بلطف يتكون الزئبق السائل في قاع أنبوب الاختبار وتتصاعد فقاعات غاز الأكسجين من أنبوب الاختبار. b. عند وضع قطع من النحاس الصلب في محلول نترات الفضة، تتكون نترات النحاس II الأزرق ويظهر فلز الفضة في المحلول. وزارة التعليم Ministry of Education 2024-1446 128

حدد عدد التأكسد لكل عنصر في المعادلتين، ثم ارسم مخططا توضح فيه التغير في عدد التأكسد الذي يحدث في كل تفاعل

اكتب المعادلة الكيميائية لكل تفاعل موصوف فيما يأتي دون كتابة المعاملات لوزنها ثم حدد حالة التأكسد لكل عنصر في المعادلة

قم بإضافة العدد الصحيح من الإلكترونات للطرف الذي يحتاج إلى لذلك ثم أعد كتابة المعادلة
استعمل طريقة نصف التفاعل لوزن معادلة تفاعل الأكسدة والاختزال الذي يحدث بين أيونات الدايكرومات وأيونات اليوديد في الوسط الحمضي
ما الذي يمكنك أن تستدل عليه عن حالة التأكسد للفوسفور في مركباته
مراجعة تراكمية تقويم الفصل 3 استخدم القائمة الآتية للإجابة عن الأسئلة من 90 إلى 93. 96 النحاس كان النحاس فلزًا مهما قبل استخلاص فلزات تحتوي خمس كؤوس على 500mL من محلول مائي تركيزه 0.250 على المواد الكيميائية الآتية: KCl.A CHOH .B Ba (OH)2 .C CH3COOH.D NaOH .E الحديد والفضة والذهب خاصة، واستعمال خاماتها في صناعة الأدوات والأواني والمجوهرات والأعمال الفنية. وكان يصهر بتسخين خاماته مع الفحم إلى درجة حرارة عالية كما كان الحال قبل 8000 سنة. قارن بين عمليات استخراج النحاس واستعمالاته في الحضارات القديمة والآن. أسئلة المستندات أعمال الزجاج تتأثر الألوان المتكونة في زجاج السيراميك 90 أي المواد ستتفكك إلى أكبر عدد من الجسيمات عندما كما في الشكل 16- بدرجة حرارة التسخين؛ حيث تكون في المحلول؟ 91 أي المواد لها أكبر كتلة مولية؟ تكسب الأيوناتُ الفلزية النحاس الذي له أكثر من حالة أكسدة ألوانًا مختلفة عند تسخينه. تتوافر كميات كبيرة 92. أي الكؤوس يمكن أن تحتوي على 9.328 من المادة من الأكسجين في أثناء عمليات الحرق مما يجعل أيونات النحاس الموجودة في الزجاج تلون اللهب باللون الأخضر الكيميائية ؟ 93. أي الكؤوس تتكون محتوياته من %18.6 أكسجين؟ المائل إلى الزرقة. وفي حالة الاختزال يوجد الأكسجين بكميات قليلة، وتزداد كمية ثاني أكسيد الكربون مما يجعل تقويم إضافي الكتابة في الكيمياء 94 الفولاذ ابحث عن دور تفاعلات الأكسدة والاختزال في صناعة الفولاذ، واكتب ملخصا للنتائج التي حصلت أيونات النحاس في الزجاج تميل إلى اللون الأحمر. عليها متضمنا الرسوم المناسبة والمعادلات التي تمثل التفاعلات. 95 الأواني الفضية اكتب طريقة لتنظيف الأواني الفضية الشكل 16-3 من الملوّثات الناتجة عن عمليات الأكسدة والاختزال. 97. اكتب معادلة لما يحدث في الآنية الخزفية الموضحة في الشكل 16-3. وتأكد من تضمين ذلك معلومات نظرية تصف فيها العملية في خطوات متسلسلة تجعل أي شخص قادرًا 98 استنادًا إلى لون آنية النحاس الخزفية، أيهما أكثر ميلاً للتأكسد، وأيهما أكثر ميلاً للاختزال؟ على تنفيذ هذه المهمة. 129 وزارة سليم Ministry of Education 2024-1446

قارن بين عمليات استخراج النحاس واستعمالاته في الحضارات القديمة والآن
استنادا إلى لون آنية النحاس الخزفية أيهما أكثر ميلا للتأكسد وأيهما أكثر ميلا للاختزال
اكتب طريقة لتنظيف الأواني الفضية من الملوثات الناتجة عن عمليات الأكسدة والاختزال
أي الكؤوس يمكن أن تحتوي على g 9.32 من المادة الكيميائية
أي الكؤوس تتكون محتوياته من 18.6% أكسجين
أي المواد ستتفكك إلى أكبر عدد من الجسيمات عندما تكون في المحلول
اختبار مقنن أسئلة الاختيار من متعدد .1 أي مما يأتي لا يعد عاملا مختزلاً في تفاعل الأكسدة والاختزال؟ .a المادة التي تأكسدت مستقبل الإلكترون المادة الأقل كهروسالبية d. مانح الإلكترون التفاعل بين النيكل وكلوريد النحاس II موضح على النحو 5. العنصر الأعلى كهروسالبية بين العناصر الآتية هو: Cl .a N .b 0 .c F.d 6. المادة التي عدد تأكسدها يساوي صفرًا هي: .a Cu2+ H₂ .b SO3²¯ 2- .c Cl- .d Ni(s) + CuCl2(aq) → Cu(s) + NiCl2(aq) الآتي: استعمل المعادلة الكيميائية في الإجابة عن السؤالين 2 و 3. .2 ما نصفا تفاعل الأكسدة والاختزال للتفاعل؟ 7. التفاعل بين يوديد الصوديوم والكلور موضح على النحو الآتي: Ni(s) → Ni²+ →Ni2+ (aq) +2e, Cl2(g) →2Cl(aq) + 2e .a : → Ni(s) Ni (s) →> Nis) + Ni 2 + (aq) (aq) . Ni2 + (aq) +2e-,2Cu+ +e-, Cu+ (aq) + e¯ +2e-, Cu²+(aq) → +2e-→ (aq) + 2e-Cu(s) .d Cu (s) .b → Cu (s) .c .3 العامل المختزل في المعادلة هو : NiCl2 .a Cu.b CuCl₂ .c Ni .d .4 رقم التأكسد للكلور في HClO هو : 2Nal(aq) 2NaI (aq) + Cl2(aq) → 2NaCl(aq) + I2(aq) أي الأسباب الآتية تبقي حالة تأكسد الصوديوم دون تغيير: .a Na أيون متفرج. Na b لا يمكن أن يختزل. Na+ .C عنصر غير متحد. Na .d أيون أحادي الذرة. أسئلة الإجابات القصيرة استعمل المعادلة أدناه للإجابة عن السؤالين 9,8، علما أن المعادلة الأيونية الكلية بين اليود وأكسيد الرصاص IV موضحة على النحو الآتي: I2(s) + PbO2(s) → 103(aq) + Pb2+ (aq) 8. حدّد عدد التأكسد لكل مشارك في التفاعل. 9 فسر كيف تحدد العنصر الذي تأكسد والعنصر الذي اختزل؟ وزارة التعليم Ministry of Education 2024-1446 +7 .a +5 .b +3.c +1 d 130

فسر كيــف تحدد العنصر الذي تأكســد والعنصر الذي اختزل
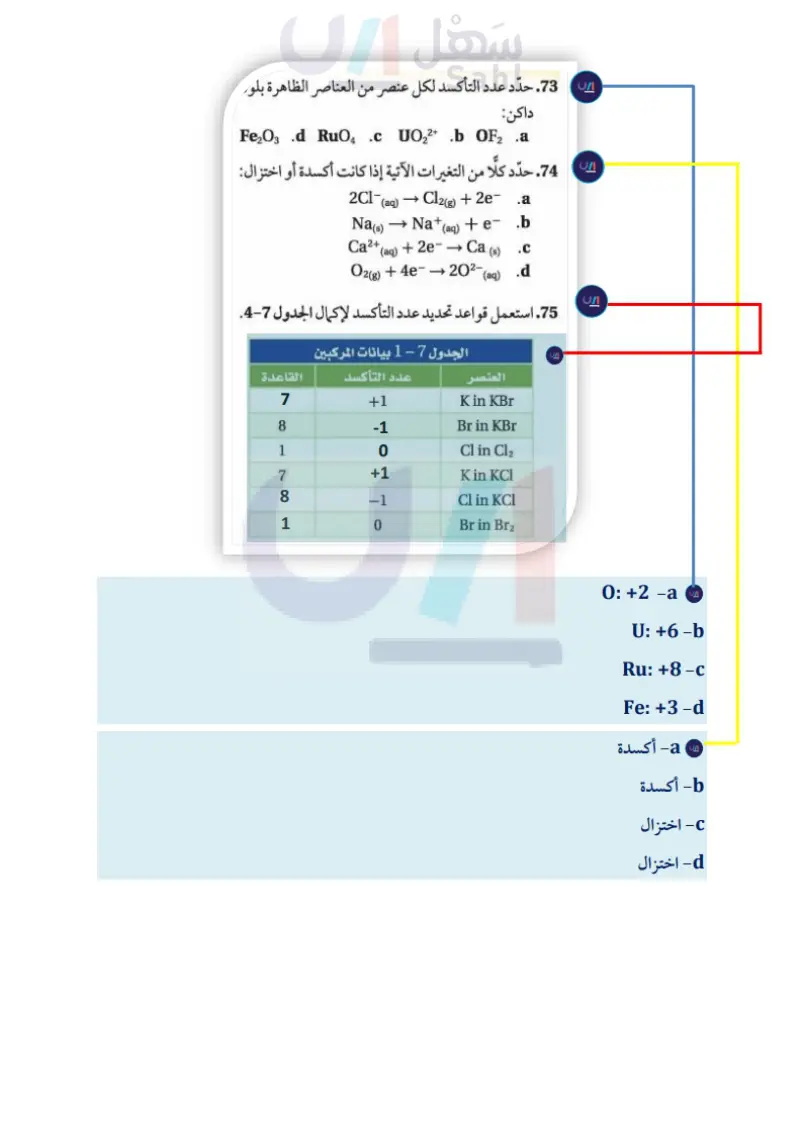
المادة التي عدد تأكسدها يساوي صفرا هي
أي الأسباب الآتية تبقي حالة تأكسد الصوديوم دون تغيير
أسئلة الإجابات المفتوحة استعمل جدول العناصر الآتي للإجابة عن الأسئلة من 10 إلى 12. الكهروسالبية 12 13 14 15 16 17 18 1 2 Li Be OF 3 Na Mg Cl الله K Ca Br LO 5 6 Cs Ba Rb | Sr 1 10. أي العناصر تمثل أقوى عامل مؤكسد؟ 11. أي العناصر تمثل أقوى عامل مختزل؟ 12. أي العناصر لها أقل كهروسالبية؟ له 7 الكهروسالبية اختبار مقنن 131 وزار سليم Ministry of Education 2024-1446