مقدمة في الأحماض والقواعد - الكيمياء 3 - ثالث ثانوي
الفصل1: المخاليط والمحاليل
الفصل2: الأحماض والقواعد
الفصل3: تفاعلات الأكسدة والاختزال
الفصل4: الكيمياء الكهربائية
مصادر تعليمية للطالب
Acids and Bases الأحماض والقواعد الفصل 21 الفكرة ( العامة يمكن تعريف الأحماض والقواعد باستعمال مفردات منها: أيونات الهيدروجين، أيونات الهيدروكسيد، أزواج الإلكترونات. 2-1 مقدمة في الأحماض والقواعد الفكرة الرئيسة تساعد النظريات المختلفة على وصف سلوك الأحماض والقواعد. 2- قوة الأحماض والقواعد الفكرة الرئيسة تتأين الأحماض والقواعد القوية في المحاليل تأينا تاما، بينما تتأين الأحماض والقواعد الضعيفة في المحاليل تأينا جزئيًا. 3- أيونات الهيدروجين والرقم الهيدروجيني الفكرة الرئيسة يعبر كل من pH و pOH عن تركيز أيونات الهيدروجين وأيونات الهيدروكسيد في المحاليل المائية. 2-4 التعادل الفكرة الرئيسة يتفاعل الحمض مع القاعدة في تفاعل التعادل لينتجا ملحا وماء. حقائق كيميائية تُعد 8.2 =pH قيمة مقبولة عمومًا للأحياء المائية، إلا أن المحافظة على هذه القيمة في حوض السمك لا يضمن استمرار نمو المخلوقات التي تعيش فيه بصورة طبيعية . تستطيع القشريات التي تعيش في المياه العذبة في أمريكا الجنوبية، العيش في مياه لها رقم هيدروجيني pH بين 6.4 و 7.0، في حين تعيش القشريات الإفريقية في مياه pH لها بين 8.0 و 9.2. تقويم النتائج قياس الرقم الهيدروجيني 82 1009 Mirtof ducation 202 1446 54

يمكن تعريف الأحماض والقواعد باستعمال مفردات منها أيونات الهيدروجين أيونات الهيدروكسيد
حقائق كيميائية قيمة مقبولة عموما للأحياء المائية
نشاطات تمهيدية تجربة استهلالية ماذا يوجد في خزائنك؟ يمكنك أن تتعلم شيئًا حول خواص المنظفات، والمنتجات التي تستعملها في منزلك، وذلك باختبارها بأشرطة تباع الشمس. هل تستطيع تصنيف تلك المنتجات في مجموعتين؟ خطوات العمل BERS OF 1 املأ بطاقة السلامة في دليل التجارب العملية. 2 ضع ثلاث إلى أربع قطرات من منتجات مختلفة في فجوات طبق التفاعلات البلاستيكي أو يمكنك استخدام أنابيب الاختبار بدلاً من ذلك. وارسم جدولاً يبين موضع كل منها. 3. اختبر كل منتج بورق تباع الشمس الأزرق والأحمر. أضف قطرتين من الفينولفثالين إلى كل عينة. ثم سجل ملاحظاتك. تحذير: الفينولفثالين قابل للاشتعال. لذا أبعده عن اللهب. التحليل المطويات الأحماض والقواعد منظمات الأفكار اعمل المطوية الآتية لتساعدك على المقارنة بين النظريات الرئيسة للأحماض والقواعد. الخطوة 1 أحضر ثلاث أوراق، واطو كلا منها عرضيًّا من المنتصف. وارسم خطا على بعد cm 3 تقريبًا من الطرف الأيسر. قص الورقة على طول هذا الخط حتى تصل إلى الثنية. كرر ذلك مع الورقتين الأخريين. الخطوة 2 عنون كل ورقة باسم نظرية من نظريات تعريف الأحماض والقواعد. الخطوة 3 ثبّت الأوراق الثلاث معًا على طول حافاتها الخارجية. نظرية أرهينيوس نظرية أرهينيوس المطويات استعمل هذه المطوية في القسم 1-2، وسجّل ملاحظاتك المتعلقة بنظريات الأحماض والقواعد في أثناء قراءة هذا القسم، ثم اكتب تفاعلات عامة تمثل كل نظرية . .1 صنّف المواد في مجموعتين، بناءً على مشاهداتك. 2 صف كيف تختلف المجموعتان؟ وماذا يمكنك أن تستنتج ؟ استقصاء اختر عينة واحدة تفاعلت مع الفينولفثالين. هل تستطيع جعل هذا التفاعل يسير بالاتجاه العكسي؟ صمم تجربة لاختبار فرضيتك. وزارة سليم 55 Ministry of Education 2024-1446

الاحماض والقواعد اعمل المطوية لمقارنة بين النظريات الرئيسة للأحماض والقواعد
رابط الدرس الرقمي 2-1 الأهداف مقدمة في الأحماض والقواعد تحدد الخواص الفيزيائية Introduction to Acids and Bases والكيميائية للأحماض والقواعد تصنف المحاليل إلى حمضية، أو قاعدية، أو متعادلة. مراجعة المفردات www.ien.edu.sa الفكرة الرئيسة تساعد النظريات المختلفة على وصف سلوك الأحماض والقواعد. الربط مع الحياة إن التصنيف الأكثر شيوعًا للمواد هو تصنيفها إلى أحماض وقواعد. ويمكن تمييز الأحماض من الطعم اللاذع لبعض المشروبات المفضلة لديك، أو الرائحة الحادة تقارن بين نظريات أرهينيوس، لبعض القواعد مثل الأمونيا في بعض المنظفات المنزلية. وبرونستد – لوري، ولويس خواص الأحماض والقواعد Properties of Acids and Bases للأحماض والقواعد. يطلق النمل حمض الميثانويك (الفورميك) عندما يشعر بخطر يهدد مستعمرته، فينته أفراد المستعمرة كلها. أما الأحماض المذابة في ماء المطر فتؤدي إلى تكوين كهوف كبيرة في الصخور تركيب لويس نموذج يستعمل الجيرية، وتؤدي أيضًا إلى تلف الأبنية والمواقع الأثرية القيمة مع مرور الزمن. وتستعمل الأحماض التمثيل النقطي للإلكترونات في إضافة نكهة إلى الكثير من المشروبات والأطعمة التي تتناولها. وهناك أيضًا حمض في المعدة ليبين كيفية ترتيب الإلكترونات يساعد على هضم الطعام. كذلك تلعب القواعد دورًا في حياتك؛ فالصابون الذي تستعمله والأقراص المضادة للحموضة التي قد تتناولها عند اضطراب المعدة كلها تعتبر من القواعد. كما أن الكثير من المواد المنزلية كالتي استعملت في التجربة الاستهلالية – أحماض أو قواعد. الخواص الفيزيائية قد تكون بعض الخواص الفيزيائية للأحماض والقواعد مألوفة، فأنت تعلم مثلاً أن المحاليل الحمضية طعمها لاذع، ومنها العديد من المشروبات الغازية التي تمتاز بهذا الطعم اللاذع بسبب احتوائها على حمضي الكربونيك H2CO3 والفوسفوريك HPO في الجزيئات. المفردات الجديدة المحلول الحمضي المحلول القاعدي نظرية أرهينيوس 4 نظرية برونستد - لوري ومنها الليمون والجريب فروت لاحتوائها على حمضي الستريك والأسكوربيك؛ كما أن حمض الحمض المرافق (المقترن) الخل يجعل طعم الخل لاذعًا. وربما تعلم أن المحاليل القاعدية طعمها مرّ، ولها ملمس زَلِق. القاعدة المرافقة (المقترنة) فكر كيف تصبح قطعة الصابون زلقة عندما تبتل. لا تحاول أبدا تعرّف أي حمض أو قاعدة أو الأزواج المترافقة أي مادة أخرى في المختبر عبر تذوقها أو لمسها. مواد مترددة (أمفوتيرية) يبين الشكل 1-2 نبتتين تنموان في تربتين مختلفتين، فإحداهما تنمو في تربة حمضية، والأخرى تنمو في تربة قاعدية (قلوية). نظرية لويس الشكل 1-2 تنمو نبتة الأثل(1) بكثرة في المملكة العربية السعودية وتمتاز بتحملها للأراضي القلوية والمالحة. تكثر زراعة الزيتون (2) في منطقة الجوف بالمملكة العربية السعودية وتمتاز شجرة الزيتون بتحملها لدرجات الحرارة العالية والقدرة على العيش في تربة حامضة. وزارة التعليم Ministry of Education 2024-1446 (2) (1) 56

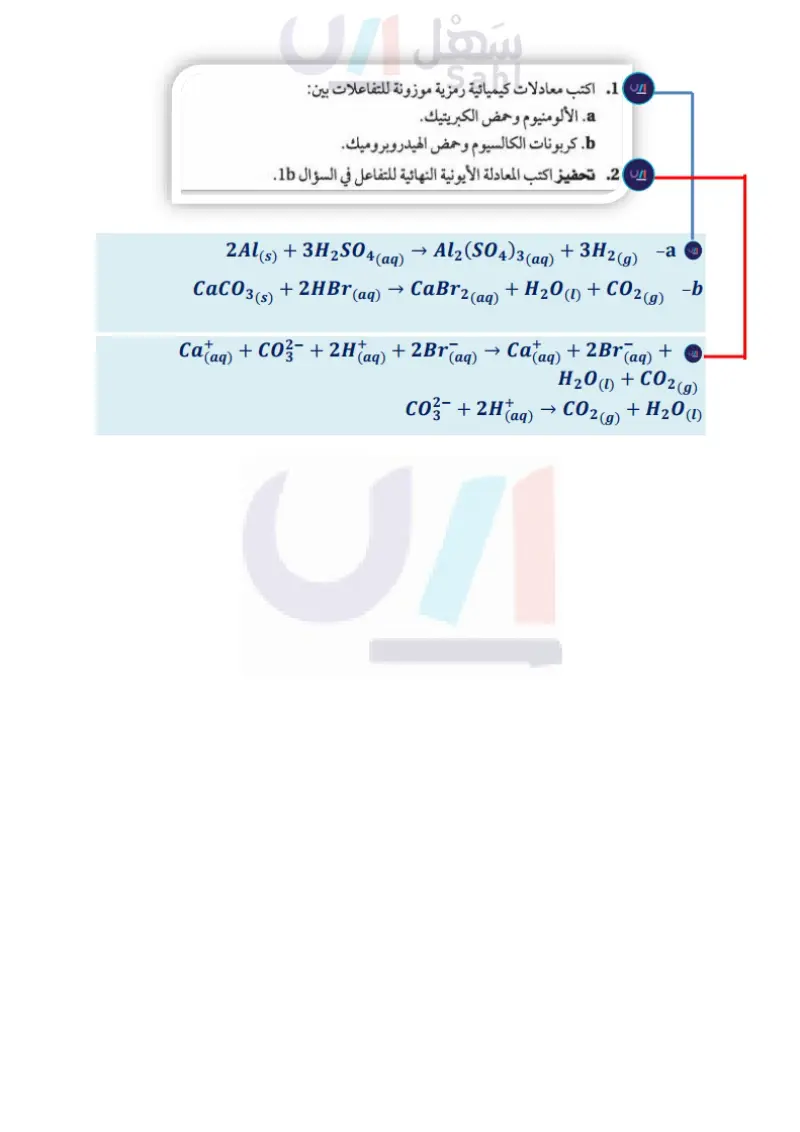
الشكل 2-2 يستعمل حمض الهيدروكلوريك HCI - وهو حمض قوي في تنظيف السيراميك. كما يساعد هيدروكسيد الصوديوم NaOH وهو قاعدة قوية على تسليك المصارف المسدودة. تحوّل الأحماض ورق تباع الشمس الأزرق إلى أحمر تحوّل القواعد ورق تباع الشمس الأحمر إلى أزرق التوصيل الكهربائي ومن الخواص الأخرى للمحاليل الحمضية والقاعدية مقدرتها على توصيل الكهرباء بسبب تأينها. فالماء النقي غير موصل للكهرباء، إلا أن إضافة حمض أو قاعدة إليه تنتج أيونات تجعل المحلول الناتج موصلاً للكهرباء. الخواص الكيميائية يمكن تعرف الأحماض والقواعد من خلال تفاعلها مع ورق تباع الشمس. ويمكن تعرُّف الأحماض أيضًا من خلال تفاعلاتها مع بعض الفلزات وكربونات الفلزات. التفاعلات مع ورق تباع الشمس يعد تباع الشمس نوعًا من الأصباغ المستعملة عادة في التمييز بين محاليل الأحماض والقواعد، كما في الشكل 22 إذ تحوّل محاليل الأحماض لون ورق تباع الشمس الأزرق إلى الأحمر، وتحول محاليل القواعد لون ورق تباع الشمس الأحمر إلى الأزرق. التفاعلات مع الفلزات وكربونات الفلزات يتفاعل كل من الماغنسيوم والخارصين مع محاليل الأحماض، فينتج عن هذا التفاعل غاز الهيدروجين. وتصف المعادلة الآتية التفاعل بين الخارصين وحمض الهيدروكلوريك: ZnCl2(aq) + H2(g) 2- 3 Zn(s) + 2HCl(aq) 3 مع وتتفاعل كربونات الفلزات CO وكربونات الفلزات الهيدروجينية و HCO أيضًا محاليل الأحماض منتجة غاز ثاني أكسيد الكربون CO2. فعند إضافة الخل إلى صودا الخبز يحدث تفاعل بين حمض الإيثانويك الخل (CH 3 COOH) وكربونات الصوديوم الهيدروجينية NaHCO، وينتج غاز 2 CO الذي يسبب ظهور الفقاعات. NaHCO3(s) + CH3COOH → CH3COONa + H2O + CO2(g) (1) يستعمل الجيولوجيون محلول حمض الهيدروكلوريك لتعرُّف الصخر الجيري (الذي يتكون بشكل رئيس من CaCO3)، فإذا أدت بضع قطرات من الحمض إلى إنتاج فقاعات ثاني أكسيد الكربون دل ذلك على أن الصخر يحتوي على مادة الجير. مسائل تدريبية 1. اكتب معادلات كيميائية رمزية موزونة للتفاعلات بين .a. الألومنيوم وحمض الكبريتيك. b كربونات الكالسيوم وحمض الهيدروبروميك. 2. تحفيز اكتب المعادلة الأيونية النهائية للتفاعل في السؤال 1b. وزارة ليم 57 Ministry of Education 2024-1446

الشكل --- لاحظ كيف يتغير كل من [+] و [-OH] في وقت واحد. فعندما يقل [H] إلى جهة اليمين تزداد قيمة [-OH] إلى اليسار. حدد على الرسم النقطة التي يكون عندها تركيزا الأيونين متساويين قاعدية [H+] متعادل حامضية [OH-] [OH-] [H+] أيونات الهيدرونيوم والهيدروكسيد تحتوي المحاليل المائية جميعها على أيونات الهيدروجين +H وأيونات الهيدروكسيد OH. وتحدد الكميات النسبية من الأيونين ما إذا كان المحلول حمضيّا أو قاعديًا أو متعادلاً. والمحاليل المتعادلة ليست حمضية ولا قاعدية. يحتوي المحلول الحمضي على أيونات هيدروجين أكثر من أيونات الهيدروكسيد. في حين يحتوي المحلول القاعدي على أيونات هيدروكسيد أكثر من أيونات الهيدروجين. أما المحلول المتعادل فيحتوي على تركيزين متساويين من أيونات الهيدروجين وأيونات الهيدروكسيد ويمثل الشكل 3-2 هذه العلاقات، في حين يمثل الشكل 24 كيف طوّر العلماء فهمهم للأحماض والقواعد. النقي أعدادًا متساوية من أيونات * وأيونات OH في عملية تسمى التأين الذاتي؛ إذ تتفاعل جزيئات الماء منتجة أيونات الهيدرونيوم ، وأيونات الهيدروكسيد. الماء ينتج H3O+ (aq) + OH- (aq) ہے H₂O(1) + H2O(1) أيون الهيدروكسيد أيون الهيدرونيوم جزيئا ماء أيون الهيدرونيوم عبارة عن أيون هيدروجين مرتبط مع جزيء ماء برابطة تساهمية. ويمكن استعمال الرمزين * و * HO بالتبادل، أي وضع أحدهما مكان الآخر، كما تبين المعادلة المبسطة للتأين الذاتي: الشكل -- تاريخ الأحماض والقواعد يرتكز الفهم الحالي للأحماض والقواعد (1) H2O =H*(aq) + OH (aq) على مساهمات علماء الكيمياء والأحياء 1869م اكتشفت الأحماض والبيئة، وكذلك على المخترعين خلال النووية مثل: DNA و RNA في نوى الخلايا. 150 سنة مضت. 58 1390 1909م ساعد تطوير تدريج العلماء على تعريف حمضية المادة. 1865م إدخال الرذاذ المعقم 1883م افترض أرهينيوس أن الذي يحتوي على حمض الكربوليك الأحماض تنتج أيونات الهيدروجين 1923م توسع العلماء في تعريف الأحماض والقواعد، وقدَّموا التعاريف (الفينول) CHOH للمرة الأولى والذي يعد بداية الجراحة الحديثة في أجواء معقمة. H، في حين تنتج القواعد أيونات الهيدروكسيد OH عند إذابتها في المستعملة حاليًا. الماء. وزارة التعليم Ministry of Education 2024-1446

نظرية أرهينيوس The Arrhenius Theory إذا كان الماء النقي متعادلاً فكيف يصبح المحلول المائي حمضيا أو قاعديا ؟ كان أول شخص يجيب عن هذا التساؤل الكيميائي السويدي سفانت أرهينيوس الذي اقترح عام 1883م ما يعرف الآن باسم نظرية أرهينيوس للأحماض والقواعد التي تنص على أن الحمض مادة تحتوي على الهيدروجين، وتتأين في المحاليل المائية منتجة أيونات الهيدروجين. والقاعدة مادة تحتوي على مجموعة الهيدروكسيد، وتتفكك في المحلول المائي منتجة أيون الهيدروكسيد. أحماض وقواعد أرهينيوس تأمل ما يحدث عند إذابة غاز كلوريد الهيدروجين في الماء بوصفه مثالاً على نظرية أرهينيوس للأحماض والقواعد؛ إذ تتأين جزيئات HCl مكوّنة أيونات * التي تجعل المحلول حمضيَّا. → H+ Cl(aq) H+ (aq) + Cl- HCl(g) الشكل 5-2- تعد بحيرة ناترون في تنزانيا تجمعًا طبيعيا للمياه القاعدية. حيث تصب المياه في وعندما يذوب المركب الأيوني هيدروكسيد الصوديوم NaOH في الماء البحيرة حاملة معها كميات كبيرة من كربونات فإنه يتحلل لينتج أيونات OH التي تجعل المحلول قاعديًّا. لل → Na+ (aq) + OH¯(aq) NaOH(s) الصوديوم الذائبة من الصخور البركانية المحيطة دون أن تجد لها مخرجًا. ويزيد التبخر وعلى الرغم من أن نظرية أرهينيوس تفسر الكثير من المحاليل الحمضية من تركيز هذا الملح، مخلّفا قشرة بيضاء على والقاعدية، إلا أنها لا تخلو من بعض السلبيات؛ فمثلاً لا تحتوي الأمونيا السطح، وجاعلاً المياه عالية القاعدية. NH وكربونات الصوديوم NaCO3 على مجموعة الهيدروكسيد، إلا أن كلا منهما ينتج أيونات الهيدروكسيد عند إذابته في الماء. وتعد كربونات الصوديوم المركب المسؤول عن جعل بحيرة ناترون في تنزانيا ذات وسط قاعدي، كما هو مبين في الشكل .5-2. لذا من الواضح أننا بحاجة إلى نظرية أكثر دقة تشمل القواعد جميعها. 1980 - 1990م لا تحتوي 1933 – 1934م طوّر مقاييس pH التي تشتمل على رقائق العلماء مقياس pH المحمول السليكون أجزاء زجاجية، وهي من المطويات أدخل معلومات هذا القسم في مطويتك. 2005م طوّر العلماء الأحماض المطورة، وهي أكثر شائعة الاستعمال الآن في الصناعات حمضية من حمض الكبريتيك الذي تركيزه 100. وتشمل تطبيقات هذه الأحماض إنتاج بلاستيك قوي الغذائية والتجميلية والدوائية. 1950 1953م درس جايمس 1970 وبنزين عالي الأوكتان. 1963م اكتشف العلماء المطر 1990 2010 واطسون، وفرانسيس كريك، الحمضي في أمريكا الشمالية؛ فقد وروزالند فرانكلين الحمض بينت الدراسات أن المطر الملوث النووي DNA، واضعين أكثر حمضية مئة مرة من المطر غير بذلك إطارا للصناعة التكنولوجية الحيوية. الملوث. وزارة سليم 59 Ministry of Education 2024-1446

بحيرة ناترون في تنزانيا
نظرية برونستد - لوري The Bronsted-Lowry Theory اقترح الكيميائي الدنماركي يوهان برونستد والكيميائي الإنجليزي توماس لوري نظريةً أشمل للأحماض والقواعد؛ حيث تركز على أيون الهيدروجين .. ففي نظرية برونستد - لوري للأحماض والقواعد يكون الحمض هو المادة المانحة لأيون الهيدروجين، في حين تكون القاعدة المادة هي المستقبلة لهذا الأيون. المواد المانحة لأيون الهيدروجين والمواد المستقبلة له إذا افترضنا أن الرمزين X و Y يمثلان عنصرين غير فلزيين أو أيونات سالبة متعددة الذرات فإننا نستطيع كتابة الصيغة العامة للحمض في صورة HX أو HY. وعندما يذوب جزيء من حمض HX في الماء يعطى أيون H الجزيء ماء، فيسلك جزيء الماء سلوك القاعدة، ويكتسب أيون ، كما في المعادلة الآتية: (aq) = H3O+ (aq) + X- حمضًا، الماء أيون H يصبح HX (aq) + H2O(1) وعند اكتساب جزيء فتصبح صيغته HO، الذي يسمى أيون الهيدرونيوم، ويعدّ حمضًا؛ لأن لديه أيون H إضافيًا يستطيع أن يمنحه. وعندما يمنح الحمض HX أيون * يصبح مادة قاعدية X؛ لأن لديه شحنة سالبة، ويستطيع أن يستقبل أيون هيدروجين موجبًا. وهكذا يمكن أن يحدث تفاعل بين حمض وقاعدة في الاتجاه المعاكس. ويستطيع الحمض HO أن يتفاعل مع القاعدة X مكونا ماء وHX، فيحدث الاتزان الآتي: (aq) +X- + X (aq) قاعدة مرافقة HX (aq) + H2O(1) = H3O+ HX(aq) حمض مرافق قاعدة حمض الأحماض والقواعد المرافقة يعدّ التفاعل الأمامي في التفاعل السابق تفاعل حمض مع قاعدة. والتفاعل العكسي لحمض وقاعدة أيضًا. ويعرف الحمض والقاعدة اللذان يتفاعلان في الاتجاه العكسي بأنهما حمض مرافق مع قاعدة مرافقة. فالحمض المرافق (المقترن) هو المركب الكيميائي الذي ينتج عندما تستقبل القاعدة أيون الهيدروجين. فالقاعدة H2O تستقبل أيون الهيدروجين من الحمض HX، فيكون الحمض المرافق .HO. أما القاعدة المرافقة (المقترنة) فهي المركب الكيميائي الذي ينتج عندما يمنح الحمض أيون الهيدروجين. فعندما يمنح الحمض HX أيون الهيدروجين يصبح القاعدة المرافقة X. وفي التفاعل المبين أعلاه يمثل أيون الهيدرونيوم * * الحمض المرافق للقاعدة HO، ويمثل أيون الشكل 6-2 يمثل الأب القاعدة المرافقة للحمض HX. وتتكون تفاعلات برونستد - لوري من أزواج مترافقة من الحمض والقاعدة؛ أي من مادتين ترتبطان معًا عن طريق منح واستقبال أيون هيدروجين واحد. عندما يرمي الكرة إلى ابنه حمض برونستد - يبين الشكل 6 تمثيلاً لزوج مترافق من حمض وقاعدة. فعندما تكون الكرة في يد الأب فإنه يمثل لوري ويمثل الابن قاعدته. الحمض، وعندما يرمي الكرة (أيون هيدروجين) إلى ابنه يصبح ابنه هو الحمض؛ لأن لديه الكرة وعندما يمسك الابن الكرة أي (أيون هيدروجين) يستطيع أن يهبه. ويصبح الأب هو القاعدة لأنه مستعد لاستقبال الكرة أي فإنه يمثل الحمض المرافق (أيون الهيدروجين). الأب يمثل الحمض والابن هو القاعدة في التفاعل الأمامي. أما في التفاعل العكسي فيكون الابن هو الحمض المرافق؛ لأن لديه الكرة، في حين يكون الأب هو القاعدة المرافقة. 60 ماذا قرأت؟ اشرح كيف يمكن أن يكون أيون HCO حمضًا وقاعدة في آن واحد. وزارة التعليم Ministry of Education 2024-1446

يمثل الأب عندما يرمي الكرة الى ابنه حمض برونستد
الشكل - يمنح فلوريد الهيدروجين أيون هيدروجين لجزيء الماء ، لذا يُعد فلوريد الهيدروجين حمضًا. حدد القاعدة المرافقة لفلوريد الهيدروجين | F- H3O+ + + 1L H2O المفردات فلوريد الهيدروجين - حمض برونستد - لوري تأمل معادلة تأين فلوريد الهيدروجين HF في الماء، المبينة في الشكل -- أي الزوجين هو الحمض، وأيهما هو القاعدة المرافقة؟ ينتج الحمض في التفاعل الأمامي - وهو في هذه الحالة فلوريد الهيدروجين- قاعدته المرافقة -F، وتعد أصل الكلمة + HF أيضًا القاعدة في التفاعل العكسي . بينما تنتج القاعدة في التفاعل الأمامي – وهو في هذه الحالة مترافق Conjugate الماء - حمضها المرافق ، وهو أيضًا الحمض في التفاعل العكسي. كلمة Conjugate + F¯(aq) قاعدة مرافقة HF (aq) + H2O(1) = H3O+ (aq) حمض مرافق قاعدة حمض معنی في اللغة العربية مترافق، وقد أخذت هذه الكلمة من اللغة اللاتينية، وهي تعني: يستعمل فلوريد الهيدروجين في صنع مركبات متنوعة تحتوي على الفلور، مثل الطبقة المغلفة لأدوات الطبخ غير اللاصقة، والمبينة في الشكل 28 ويعد حمضًا وفق نظريتي أرهينيوس وبرونستد - لوري. الأمونيا - قاعدة برونستد - لوري معظم الأحماض والقواعد التي تتفق مع تعريف أرهينيوس للأحماض والقواعد تتفق أيضًا مع تعريف برونستد - لـــوري. ولكن بعض المواد الأخرى التي لا توجد فيها مجموعة الهيدروكسيد لا يمكن أن تُعَدَّ من القواعد بحسب تعريف أرهينيوس، ولكنها تصنف قواعدًا بحسب نظرية برونستد - لوري. ومن ذلك الأمونيا NH3. فعندما تذوب الأمونيا في الماء يكون الماء حمضًا بحسب تعريف برونستد - لوري في التفاعل الأمامي. ولأن جزيء الأمونيا NH3 يستقبل أيون "H ليكون أيون الأمونيوم NHA فإن الأمونيا تُصنّف قاعدة برونستد - لوري في التفاعل الأمامي. + OH(aq) NH3(aq) + H2O(1) = NH4+ (aq) + OH قاعدة حمض حمض مرافق قاعدة مرافقة Con- بادئة بمعنى مع أو معًا. jugate فعل بمعنى يتصل أو يتحد. + 4 الشكل 28 يتفاعل فلوريد أما في التفاعل العكسي فيعطي أيون الأمونيوم * NH أيون " ليكون جزيء أمونيا. وهكذا يعمل عمل حمض، بحسب برونستد - لوري. ويكون بذلك أيون الأمونيوم هو الحمض المرافق الهيدروجين مع مركبات عضوية للقاعدة (الأمونيا). ويتقبل أيون الهيدروكسيد أيون ليكون جزيء ماء. وهكذا يكون قاعدة تسمى الهيدروكربونات لصنع بحسب برونستد - لوري. لذا يكون أيون الهيدروكسيد هو القاعدة المرافقة للحمض والماء. السطح الناعم غير اللاصق لهذه الماء - حمض وقاعدة برونستد - لوري تذكر أنه عندما يذوب HF في الماء فإن الماء يسلك الأدوات المنزلية، حيث تحل ذرات سلوك القاعدة؛ وعندما تذوب الأمونيا NH3 في الماء، فإن الماء يسلك سلوك الحمض. لذا يسلك الفلور محل ذرات الهيدروجين. الماء سلوك الحمض أو القاعدة بحسب طبيعة المواد المذابة في المحلول . ويُسمى الماء والمواد الأخرى التي تستطيع أن تسلك سلوك الأحماض والقواعد مواد مترددة (أمفوتيرية) Amphoteric. 61 وزار قس ليم Ministry of Education 2024-1446

يتفاعل فلوريد الهيدروجين مع مركبات عضوية تسمى الهيدروكربونات لصنع السطح الناعم
أصل كلمة مترفق
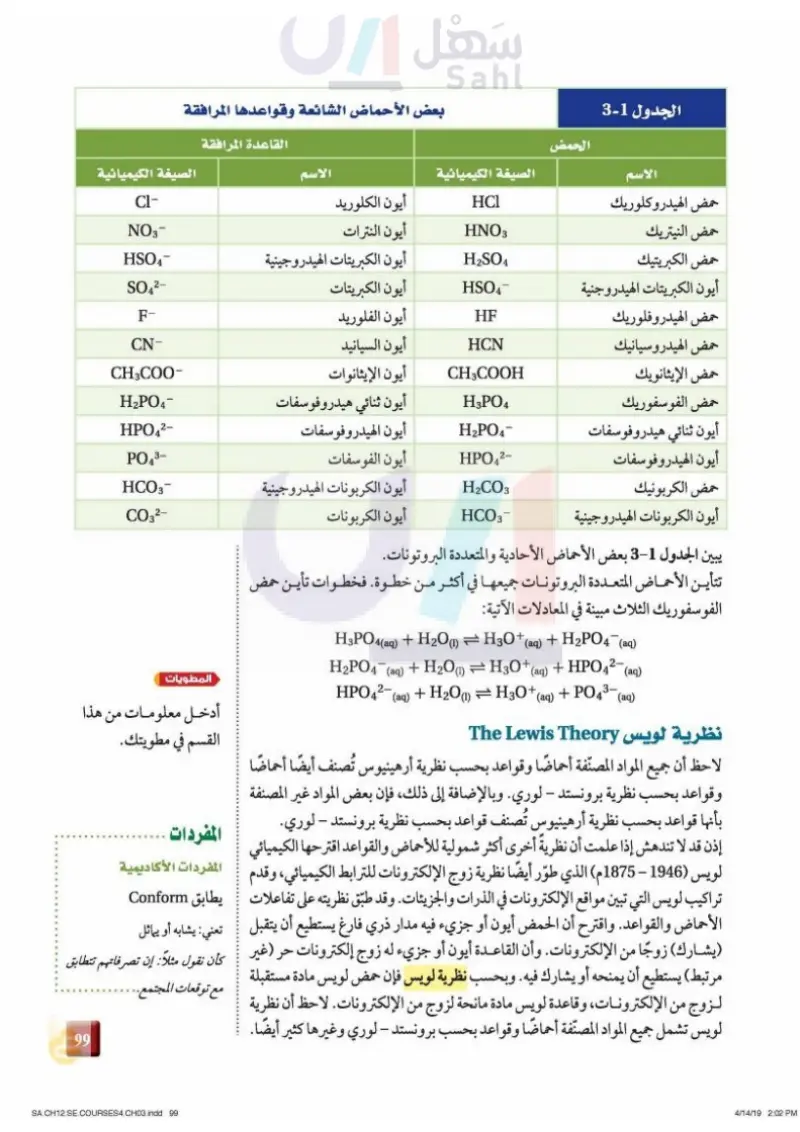
مسائل تدريبية 3. حدّد الأزواج المترافقة من الحمض والقاعدة في كل تفاعل مما يلي: NH4+ (aq) + OH(aq) = NH3(aq) + H2O (1) .a .b HBr (aq) + H2O(1) = H3O+ (aq) + Br¯ CO32(aq) + H2O(1) = HCO3(aq) + OH(aq) .C H I-O-I H-C-C H زر б O-H 8+ حمض الإيثانويك 6- 8+ H-F فلوريد الهيدروجين H H. CH Η H بنزين Η 2- 4 هي قاعدة HO و SO2. 4 تحفيز إذا علمت أن نواتج تفاعل حمض مع اكتب معادلة موزونة للتفاعل، وحدّد الأزواج المترافقة من الحمض والقاعدة. الأحماض الأحادية البروتون والمتعددة البروتونات Monoprotic and Polyprotic Acids تستطيع أن تعرف أن كلا من HCI و HF حمض يحتوي على أيون هيدروجين واحد في كل جزيء، بناءً على معرفتك للصيغة الكيميائية لكل منهما. فالحمض الذي يستطيع أن يمنح أيون هيدروجين واحدًا فقط يُسمى حمضًا أحادي البروتون. ومن الأحماض الأحادية البروتون حمض البيروكلوريك HClO، وحمض النيتريك 4 HNO3 ، وحمض الهيدروبروميك HBr، وحمض الإيثانويك CH COOH. ولأن الشكل - تعتمد قدرة الهيدروجين حمض الإيثانويك أحادي البروتون لذا تكتب صيغته غالبًا في صورة CH3COOH على التأين على قطبية رابطته. ففي لتأكيد حقيقة أن ذرة هيدروجين واحدة فقط من الذرات الأربع قابلة للتأين. حمض الإيثانويك يكون الأكسجين ذرات الهيدروجين القابلة للتأين الفرق بين ذرة الهيدروجين القابلة للتأين في حمض أكثر كهروسالبية من الهيدروجين الإيثانويك وذرات الهيدروجين الثلاث الأخرى هو أن الذرة القابلة للتأين مرتبطة لذا تكون الرابطة بين الأكسجين مع عنصر الأكسجين الأكثر كهروسالبية من الهيدروجين. والفرق في الكهروسالبية والهيدروجين قطبية. ولذلك تستطيع يجعل الرابطة بين الأكسجين والهيدروجين قطبية. ويبين الشكل 9-2 تركيب حمض ذرة الهيدروجين أن تتأين في المحلول. الإيثانويك، مع تركيب حمض HF وتركيب البنزين CH غير الحمضي فترتبط ذرة كذلك في فلوريد الهيدروجين يعد الفلور الهيدروجين في مركب فلوريد الهيدروجين مع ذرة الفلور العالية الكهروسالبية، لذا عالي الكهروسالبية، لذا يكون HF فالرابطة بينهما قطبية، وتصبح ذرة الهيدروجين قابلة للتأين إلى حد ما. أما ذرات حمضًا في المحلول، بينما في البنزين الهيدروجين في البنزين فكل منها مرتبط مع ذرة كربون ذات كهروسالبية تساوي هناك فرق قليل في الكهروسالبية تقریبًا كهروسالبية الهيدروجين . فتكون هذه الروابط غير قطبية، لذا يكون البنزين غير بين ذرات الكربون والهيدروجين، لذا حمضي. وقد تمنح بعض الأحماض أكثر من أيون هيدروجين. فمثلا يستطيع كل من حمض الكبريتيك H2SO4 وحمض الكربونيك H2CO3 أن يمنح أيوني هيدروجين؛ فكلاهما يحتوي على ذرتي هيدروجين مرتبطتين مع ذرتي أكسجين بروابط قطبية. والأحماض التي تحتوي على ذرتي هيدروجين قابلتين للتأين في كل جزيء تُســــمـى أحماضًا ثنائية البروتونات. ويحتوي كل من حمضي الفوسفوريك HPO4 والبوريك 3 HBO على ثلاث ذرات هيدروجين قابلة للتأين في كل جزيء، وتُسمى أحماضًا ثلاثية البروتونات. ويمكن استعمال مصطلح حمض متعدد البروتونات لأي حمض يحتوي على أكثر من ذرة هيدروجين قابلة للتأين. فالبنزين ليس حمضًا. وزارة التعليم Ministry of Education 2024-1446 62

الجدول 1-2 بعض الأحماض الشائعة وقواعدها المرافقة القاعدة المرافقة الحمض الاسم حمض الهيدروكلوريك حمض النيتريك حمض الكبريتيك الصيغة الكيميائية الاسم أيون الكبريتات الهيدروجنية حمض الهيدروفلوريك حمض الهيدروسيانيك حمض الإيثانويك حمض الفوسفوريك أيون ثنائي هيدروفوسفات أيون الهيدروفوسفات حمض الكربونيك أيون الكربونات الهيدروجينية يبين الجدول 2011 بعض الأحماض الأحادية والمتعددة البروتونات. تتأين الأحماض المتعددة البروتونات جميعها في أكثر من خطوة. فخطوات تأين حمض HCl HNO 3 H2SO4 HSO4- HF HCN CH3COOH H3PO4 H2PO4¯ HPO42- H2CO3 HCO3- أيون الكلوريد أيون النترات أيون الكبريتات الهيدروجينية أيون الكبريتات أيون الفلوريد أيون السيانيد أيون الإيثانوات أيون ثنائي هيدروفوسفات أيون الهيدروفوسفات أيون الفوسفات أيون الكربونات الهيدروجينية أيون الكربونات الفوسفوريك الثلاث مبينة في المعادلات الآتية: H3PO4(aq) + H2O(1) = H3O+ (aq) + H2PO4¯¯(aq) H2PO4 (aq) + H2O(1) = H3O+ (aq) + HPO4²¯¯ (aq) HPO4² (aq) + H2O(1) = H3O+ (aq) + PO4³- (aq) الصيغة الكيميائية CI- NO3- HSO4- SO42- F- CN- CH3COO- H2PO4- HPO42- PO43- HCO3- CO32- المطويات أدخل معلومات من هذا القسم في مطويتك. نظرية لويس The Lewis Theory لاحظ أن جميع المواد المصنّفة أحماضًا وقواعد بحسب نظرية أرهينيوس تُصنف أيضًا أحماضًا وقواعد بحسب نظرية برونستد - لوري. وبالإضافة إلى ذلك، فإن بعض المواد غير المصنفة بأنها قواعد بحسب نظرية أرهينيوس تُصنف قواعد بحسب نظرية برونستد - لوري. المفردات إذن قد لا تندهش إذا علمت أن نظريةً أخرى أكثر شمولية للأحماض والقواعد اقترحها المفردات الأكاديمية الكيميائي لويس (1946 - 1875م) الذي طوّر أيضًا نظرية زوج الإلكترونات للترابط الكيميائي، وقدم تراكيب لويس التي تبين مواقع الإلكترونات في الذرات والجزيئات. وقد يطابق Conform طبق نظريته على تفاعلات الأحماض والقواعد. واقترح أن الحمض أيون أو جزيء فيه مدار تعني: يشابه أو يماثل ذري فارغ يستطيع أن يتقبل ( يشارك) زوجًا من الإلكترونات. وأن القاعدة أيون أو جزيء كأن نقول مثلا: إن تصرفاتهم تتطابق له زوج إلكترونات حر (غير مرتبط) يستطيع أن يمنحه أو يشارك فيه. وبحسب نظرية لويس مع توقعات المجتمع.. فإن حمض لويس مادة مستقبلة لزوج من الإلكترونات، وقاعدة لويس مادة مانحة لزوج من الإلكترونات. لاحظ أن نظرية لويس تشمل جميع المواد المصنّفة أحماضًا وقواعد بحسب برونستد - لوري وغيرها كثير أيضًا. 63 وزار قس ليم Ministry of Education 2024-1446

المفردات الأكاديمية يطابق
مانحات ومستقبلات أزواج الإلكترونات تأمل التفاعل بين أيون الهيدروجين " وأيون الفلوريد F لتكوين جزيء فلوريد الهيدروجين (HF). لقد تم توضيح دور زوج الإلكترونات من خلال تراكيب لويس الآتية: H-: H+ + :: قاعدة لويس حمض لويس يمثل أيون *H في هذا التفاعل حمض لويس؛ حيث يستقبل مدار 1s الفارغ زوجًا من الإلكترونات من أيون F. ويمثل أيون الفلوريد قاعدة لويس، لذا فهو يعطي زوجًا من الإلكترونات غير المشترك ليكون الرابطة بين الهيدروجين والفلور في HF. لاحظ أن هذا التفاعل يتطابق أيضًا مع نظرية برونستد – لوري للأحماض والقواعد؛ لأن H يمكن اعتباره مانحًا لأيون هيدروجين ، و F مستقبلاً لأيون هيدروجين. فتفاعل غاز ثالث فلوريد البورون BF مع غاز الأمونيا NH لتكوين BF H هو تفاعل حمض لويس مع قاعدة لويس. 3 :: H :F: H - B :N-H :: - B N-H | | :F: H :F: H قاعدة لويس حمض لويس وإن ذرة البورون في 3 لها ستة إلكترونات تكافؤ ، لذا يستطيع المدار الفارغ أن يستقبل زوجًا من الإلكترونات من قاعدة لويس. ويحدث تفاعل حمض لويس مع قاعدة لويس أيضًا عندما يتفاعل غاز ثالث أكسيد الكبريت SO مع أكسيد الماغنسيوم الصلب MgO SO3(g) + MgO (s) MgSO4(s) →> حيث يمثل زوج الحمض - القاعدة في هذا التفاعل ثالث أكسيد الكبريت SO وأيون الأكسيد 02 من أكسيد الماغنسيوم، أما الناتج فهو أيون الكبريتات. || :O: :Ö: S :O: 0:2- قاعدة لويس :Ö: 2- S-O S -ة: :0 :0: حمض لويس لاحظ أن حمض لويس-وهو في هذه الحالة جزيء 3 SO- يستقبل زوج إلكترونات من قاعدة لويس، وهو أيون 02 . ويلخص الجدول - نظريات أرهينيوس، وبرونستد - لوري، ولويس للأحماض والقواعد . الجدول 2-2 - ملخص النظريات الثلاث للأحماض والقواعد وزارة التعليم Ministry of Education 2024-1446 تعريف القاعدة منتج OH- مستقبل H تعريف الحمض منتج H مانح H يستقبل زوجًا من الإلكترونات يمنح زوجا من الإلكترونات النظرية أرهينيوس برونستد - لوري لويس 64

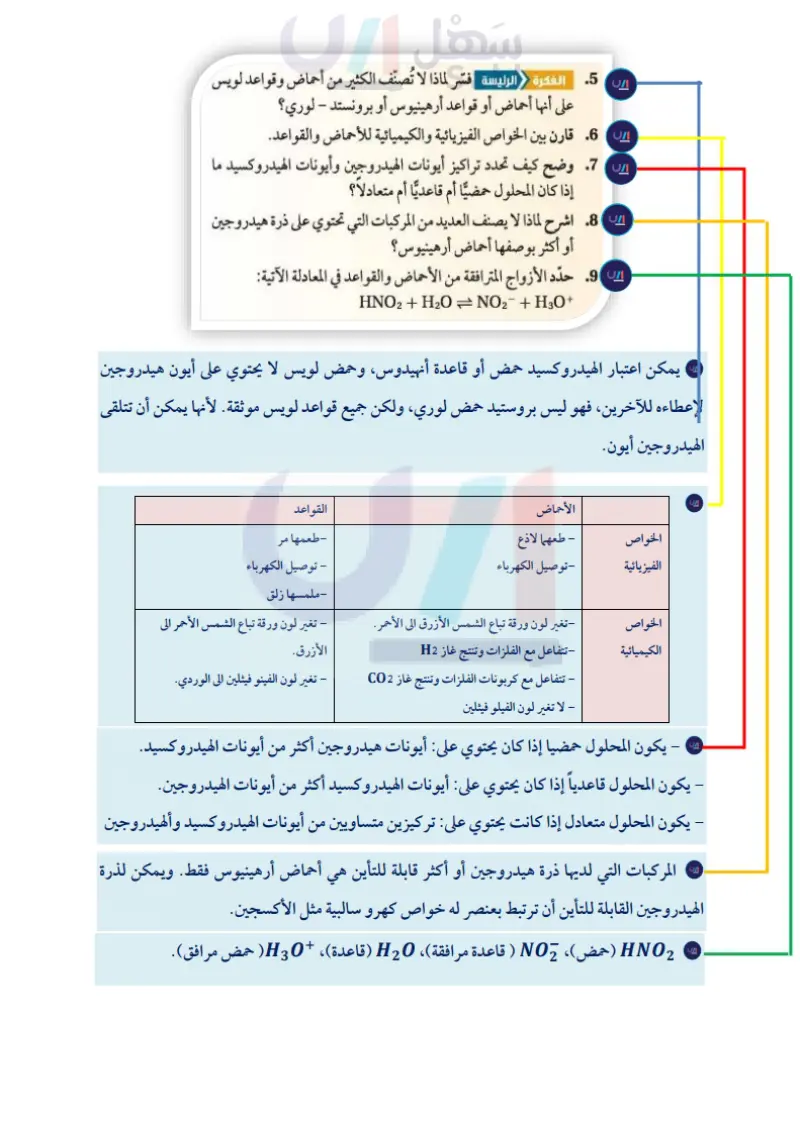
يعد تفاعل 50 مع MgO مهما؛ لأنه ينتج بلورات من ملح كبريتات الماغنسيوم، تعرف باسم ملح إبسوم 720 MSO. ولهذا الملح استعمالات كثيرة، منها تخفيف آلام العضلات، وهو مغذ للنباتات. وللتفاعل الذي ينتج كبريتات الماغنسيوم أيضًا تطبيقات بيئية؛ فعندما يحقن MgO في الغازات الخارجة من مداخن محطات توليد الطاقة الكهربائية التي تعمل بالفحم الحجري، كما في الشكل 10-2 فإنه يتفاعل مع SO ويعمل على انتزاعه من الغازات العادمة الخارجة من المصنع إلى الجو. أما إذا ترك SO لينتشر في الغلاف الجوي فسوف يتحد مع الم الموجود في الهواء مكونًا حمض الكبريتيك الذي يسقط على الأرض في صورة مطر حمضي. علم الأرض الأنهيدريدات تتحد جزيئات غاز ثاني أكسيد الكربون الربط 3 الماء بجزيئات الماء في الجو لتكون حمض الكربونيك H2CO3 ، الذي يهطل مع المطر، وعندما الشكل 10-2 يمكن إزالة ثالث يصل ماء المطر الحمضي إلى الأرض يتسرب جزء منه في التربة ليصل إلى الصخور الجيرية، أكسيد الكبريت – وهو أحد الغازات فيؤدي إلى إذابتها ببطء، مما يسبب تكوّن كهوف ضخمة تحت الأرض عبر آلاف السنين العادمة الناتجة عن احتراق وتقطر المياه من سقوف الكهوف مخلّفة الجير المذاب. وهذا الجير يتكون على هيئة رقاقات الفحم الحجري بتفاعله جليدية تتدلى من السقف تسمى الهوابط. وكذلك تتكون كتل من كربونات الكالسيوم الماغنسيوم في تفاعل حمض وقاعدة على أرض الكهوف تسمى الصواعد. لويس. لاحظ أنه رغم خروج كميات جزئ مع أكسيد تتكون مثل هذه الكهوف لأن ثاني أكسيد الكربون أنهيدريد حمضي (حمض منزوع منه كبيرة من البخار من أبراج التبريد ماء)، وهو أكسيد يستطيع أن يتحد مع الماء ليكوّن حمضًا. وهناك أكاسيد أخرى إلا أن الذي يمكن رؤيته من المدخنة تتحد مع الماء مكوّنة قواعد. فمثلاً يكوّن أكسيد الكالسيوم CaO (الجير الحي) عندما يذوب في الماء القاعدة هيدروكسيد الكالسيوم (Ca(OH (الجير المطفأ). وعموما تكوّن أكاسيد العناصر الفلزية القواعد ؛ بينما تكوّن أكاسيد اللافلزات الأحماض. قليل. L التقويم 1-2 الخلاصة .5 الفكرة الرئيسة فسّر لماذا لا تُصنّف الكثير من أحماض وقواعد لويس تحدّد تراكيز أيونات الهيدروجين وأيونات على أنها أحماض أو قواعد أرهينيوس أو برونستد - لوري؟ الهيدروكسيد ما إذا كان المحلول حمضيا، أم 6 قارن بين الخواص الفيزيائية والكيميائية للأحماض والقواعد. قاعديًا، أم متعادلا. 7 وضح كيف تحدد تراكيز أيونات الهيدروجين وأيونات الهيدروكسيد ما يجب أن يحتوي حمض أرهينيوس على ذرة هيدروجين إذا كان المحلول حمضيا أم قاعديًا أم متعادلاً؟ قابلة للتأين. ويجب أن تحتوي قاعدة أرهينيوس على 8. اشرح لماذا لا يصنف العديد من المركبات التي تحتوي على ذرة هيدروجين مجموعة هيدروكسيد قابلة للتأين. أو أكثر بوصفها أحماض أرهينيوس؟ حمض برونستد - لوري مادة مانحة لأيون 9. حدّد الأزواج المترافقة من الأحماض والقواعد في المعادلة الآتية: هيدروجين، بينما قاعدة برونستد – لوري مادة مستقبلة لأيون هيدروجين. حمض لويس مادة تستقبل زوجًا من الإلكترونات بينما قاعدة لويس مادة تعطي زوجا من الإلكترونات. - HNO2 + H2O = NO2 + H3O+ 10. اكتب تركيب لويس لثالث كلوريد الفوسفور PCl. هل يعد PCl حمض لويس، أم قاعدة لويس، أم غير ذلك؟ 65 وزارة سليم Ministry of Education 2024-1446

خلاصة درس مقدمة الأحماض والقواعد
يمكن إزالة ثالث أكسيد الكبريت