العوامل المؤثرة في الذوبان - الكيمياء 3 - ثالث ثانوي
الفصل1: المخاليط والمحاليل
الفصل2: الأحماض والقواعد
الفصل3: تفاعلات الأكسدة والاختزال
الفصل4: الكيمياء الكهربائية
مصادر تعليمية للطالب
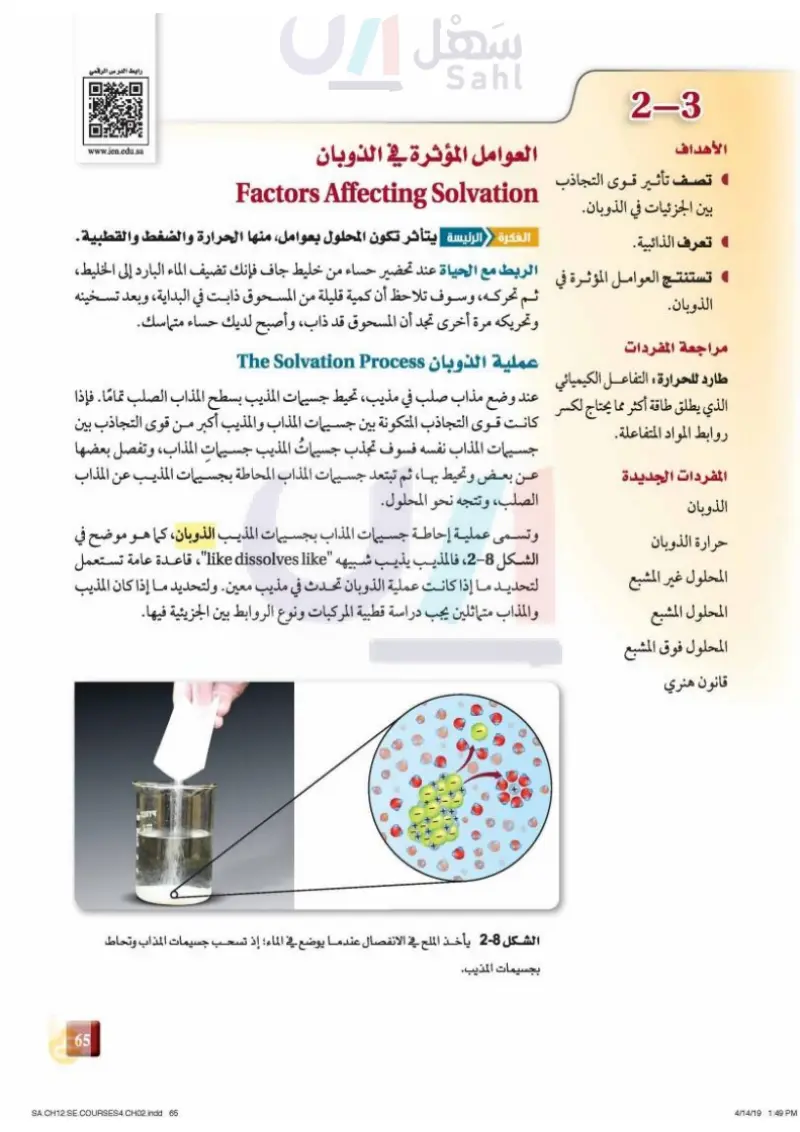
1-3 رابط الدرس الرقمي الأهداف تصف تأثير قوى التجاذب بين الجزئيات في الذوبان. ) تعرف الذائبية. العوامل المؤثرة في الذوبان Factors Affecting Solvation www.ien.edu.sa الفكرة الرئيسة يتأثر تكون المحلول بعوامل منها الحرارة والضغط والقطبية تستنتج العوامل المؤثرة في الربط مع الحياة عند تحضير حساء من خليط جاف فإنك تضيف الماء البارد إلى الخليط، الذوبان. مراجعة المفردات طارد للحرارة : التفاعل الكيميائي الذي يطلق طاقة أكثر مما مما يحتاج لكسر روابط المواد المتفاعلة. المفردات الجديدة الذوبان حرارة الذوبان المحلول غير المشبع المحلول المشبع المحلول فوق المشبع قانون هنري ثم تحركه، وسوف تلاحظ أن كمية قليلة من المسحوق ذابت في البداية، وبعد تسخينه وتحريكه مرة أخرى تجد أن المسحوق قد ذاب، وأصبح لديك حساء متماسك. عملية الذوبان The Solvation Process عند وضع مذاب صلب في مذيب، تحيط جسيمات المذيب بسطح المذاب الصلب تماما . فإذا كانت قوى التجاذب المتكونة بين جسيمات المذاب والمذيب أكبر من قوى التجاذب بين جسيمات المذاب نفسه فسوف تجذب جسيمات المذيب جسيمات المذاب، وتفصل بعضها عن بعض وتحيط بها، ثم تبتعد جسيمات المذاب المحاطة بجسيمات المذيب عن المذاب الصلب، وتتجه نحو المحلول. وتسمى عملية إحاطة جسيمات المذاب بجسيمات المذيب الذوبان، كما هو موضح في الشكل 8-1، فالمذيب يذيب شبيهه like a dissolves like"، قاعدة عامة تستعمل لتحديد ما إذا كانت عملية الذوبان تحدث في مذيب معين. ولتحديد ما إذا كان المذيب والمذاب متماثلين يجب دراسة قطبية المركبات ونوع الروابط بين الجزيئية فيها. الشكل 8-1 يأخذ الملح في الانفصال عندما يوضع في الماء؛ إذ تسحب جسيمات المذاب وتحاط بجسيمات المذيب. 29 وزارة السليم Ministry of Education 2024-1446

أهداف درس العوامل المؤثرة في الذوبان
30 الشكل 9-1 يذوب كلوريد الصوديوم في الماء عندما تحيط جزيئات الماء بأيونات الصوديوم والكلوريد. لاحظ كيف تحيط جزيئات الماء القطبية بكل من أيونات الكلور السالبة وأيونات الصوديوم الموجبة. ذوبان ملح الطعام NaCl في الماء أيونات محاطة بجزيئات الماء أيونات CI أيونات Na جزيئات الماء محاليل المركبات الأيونية تعلم أن جزيئات الماء قطبية، وأنها في حركة مستمرة، بحسب نظرية الحركة الجزيئية. فعند وضع بلورة من مركب أيوني مثل كلوريد الصوديوم (NaCl) في الماء تصطدم جزيئات الماء بسطح البلورة. وعندها تجذب أقطاب جزيئات الماء المشحونة أيونات الصوديوم الموجبة وأيونات الكلوريد السالبة. وهذا التجاذب بين الأقطاب والأيونات أكبر من التجاذب بين الأيونات في البلورة. لذلك تنزلق الأيونات مبتعدة عن سطح البلورة. وتحيط جزيئات الماء بالأيونات وتسحبها نحو المحلول، معرّضةً أيونات أخرى على سطح البلورة للذوبان، وهكذا تستمر عملية الذوبان حتى تذوب البلورة كلها، انظر الشكل 9-1. لا يمكن إذابة ميع المركبات الأيونية في الماء؛ فالجبس مثلا لا يذوب في الماء؛ لأن قوى التجاذب بين أيونات الجبس قوية؛ بحيث لا تستطيع قوى التجاذب بين جزيئات الماء والأيونات التغلب عليها . ولقد أسهمت اکتشافات محاليل و مخاليط معينة ـ ومنها الجبيرة الطبية المحضرة من الجبس - في تطوير الكثير من المنتجات والعمليات، كما هو موضح في الشكل 10-1. الشكل 10-1 كيمياء المحاليل أسهم العلماء العاملون في مجال المحاليل الكيميائية في تطوير منتجات وعمليات تتضمن 1883م أول نجاح العملية طرد مركزي تستعمل الدوران مجالات التقنية الطبية، وتحضير الطعام وحفظه السريع لفصل مكونات المخلوط. والصحة العامة والسلامة. 1870 1890 1916م طوّر الأطباء محلول الجلسرول الذي يسمح بتخزين الدم عدة أسابيع بعد سحبه. 1866م كان اختراع السلولويد -وهو محلول من الكافور والسليلوز إشارة إلى بدايات صناعة البلاستيك. 1899م سجلت براءة اختراع جديدة لأحدث تقنية تستخدم في التقليل من حجم حبيبات الدهن الذائبة في الحليب؛ لمنع تكوّن طبقة زبد في عملية تسمى التجانس. وزارة التعليم Ministry of Education 2024-1446

I...O H H...O HO... H-O H C- CH2 OH CH2 H -C H I-O-O H I- H H O-H H I-- CH2- H H-O H محاليل المركبات الجزيئية يعد الماء مذيبًا جيدًا للكثير من المركبات الجزيئية. فسكر الشكل 11-1 يحتوي جزيء المائدة عبارة عن المركب الجزيئي السكروز، وتحتوي جزيئاته القطبية على عدة روابط من السكروز على 8 روابط - 0 H - ، كما هو موضح في الشكل 11-1. وبمجرد ملامسة بلورات السكر الماء، تصطدم قطبية، وتكوّن جزيئات الماء القطبية جزيئات الماء بالسطح الخارجي للبلورات، وتصبح كل رابطة O - H في السكروز موقعًا روابط هيدروجينية مع الروابط لتكوين روابط هيدروجينية مع الماء، لذا يتم التغلب على قوى التجاذب بين جزيئات H - 0 في السكروز، وتسحب السكروز بقوى التجاذب التي تتكون بين جزيئاته وجزيئات الماء القطبية، فتترك جزيئات جزيئات السكروز نحو المحلول. السكروز البلورة، وتصبح ذائبة في الماء. يتكون الزيت من الكربون والهيدروجين، ولا يكوّن محلولاً مع الماء؛ وذلك لأن قوى التجاذب التي تتكون بين جزيئات الماء القطبية وجزيئات الزيت غير القطبية ضعيفة. لذا يذوب الزيت في مذيب غير قطبي؛ لأن المذاب غير القطبي يذوب بسهولة أكبر في المذيب غير القطبي. 2010 1964م اكتشفت ستيفاني كوالك 2003م طوّر العلماء عينات كيميائية تزيل الفلزات أليافا اصطناعية من بلورات سائلة في السامة، والمبيدات الحشرية، وتقتل مسببات الأمراض في محلول. وهي أكثر صلابة من الفولاذ مياه الشرب. وأخف من الألياف الزجاجية. 31 وزارة سليم Ministry of Education 2024-1446 1990 1970 1950 1943م أول كلية اصطناعية تخلص الجسم من السموم الذائبة في دم المريض. 1980م تم تطوير نوع من ألواح الجبس لتشكل عازلاً يفصل بين المنزل ومحيطه الخارجي

مكعب من السكر حرارة الذوبان تنفصل جسيمات المذاب بعضها عن بعض خلال عملية الذوبان، وتتباعد جسيمات المذيب لتسمح الجسيمات المذاب بالدخول بينها. ويلزم طاقة للتغلب على قوى التجاذب التي بين جسيمات المذاب والتي بين جسيمات المذيب، والتي تعرف طاقة الشبكة البلورية ويرمز لها بالرمز (طب ) أو (U) ، لذلك فكلتا الخطوتين ماصة للطاقة. وعند خلط جسيمات المذيب مع جسيمات المذاب تتجاذب جسيماتهما وتنطلق طاقة تعرف طاقة التميه ويرمز لها بالرمز (طه) أو (Hiya)، لذا فإن هذه الخطوة في عملية الذوبان طاردة للطاقة. ويسمى التغير الكلي للطاقة الذي يحدث خلال عملية تكون المحلول حرارة الذوبان. يذوب مكعب السكر في الشاي المثلج ببطء، وكما لاحظت في التجربة الاستهلالية أن بعض المحاليل تُنتج طاقة في أثناء تكونها وتزداد سرعة الذوبان عند تحريكه. طاردة للطاقة)، وبعضها الآخر يمتص طاقة في أثناء تكونه (ماصة للطاقة). فمثلاً بعد ذوبان نترات الأمونيوم في وعاء يحوي ماء يصبح الوعاء باردًا، أما بعد ذوبان كلوريد الكالسيوم في وعاء يحوي ماء فيصبح الوعاء ساخنًا. ماذا قرأت؟ فسّر لماذا تنتج بعض المحاليل طاقة في أثناء تكونها بينما يمتص بعضها الآخر طاقة في أثناء تكونه؟ العوامل المؤثرة في الذوبان Factors That Affect Solvation يحدث الذوبان عند تصادم جسيمات المذاب والمذيب معا. ويبين الشكل 12-1 يذوب السكر المطحون بسرعة أكبر ثلاث طرائق شائعة لزيادة التصادمات بين جسيمات المذاب والمذيب وزيادة سرعة من مكعب السكر في الشاي المثلج، كما يزيد التحريك من سرعة ذوبان السكر الذوبان، وهي: التحريك، وزيادة مساحة سطح المذاب، ورفع درجة حرارة المطحون. المذيب. التحريك يعمل تحريك المحلول على إبعاد جسيمات المذاب عن سطوح التماس بسرعة أكبر، وبذلك يسمح بحدوث تصادمات أخرى بين جسيمات المذاب والمذيب. ومن دون تحريك المحلول تتحرك الجسيمات الذائبة بعيداً عن مناطق التماس ببطء. مساحة السطح إن تكسير المذاب إلى قطع صغيرة يزيد من مساحة سطحه. وتساعد الزيادة في مساحة السطح على زيادة عدد التصادمات التي تحدث بين جسيماته وجسيمات المذيب. لذا فإن ملعقة من السكر المطحون تذوب أسرع من يذوب السكر المطحون بسرعة كبيرة جدًّا الكمية نفسها التي تكون في صورة مكعبات. الحرارة تتأثر سرعة الذوبان بدرجة الحرارة؛ فالمذيب الساخن يذيب كمية أكبر في الشاي الساخن. من المذاب مقارنة بالمذيب البارد. لذلك يستوعب الشاي الساخن سكرًا ذائبًا أكثر الشكل 12-1 يؤثر كل من التحريك، من الشاي المثلج، كما أن السكر يذوب فيه أسرع . ومع زيادة درجة الحرارة تسلك ومساحة السطح، ودرجة الحرارة في معظم المواد الصلبة سلوك السكر عند الذوبان. إلا أن ذوبان بعض المواد الأخرى، سرعة الذوبان. ومنها الغازات، يقل بزيادة درجة الحرارة، وهذا يجعل المشروبات الغازية تفقد طعمها اللاذع أسرع عند درجة حرارة الغرفة، مما لو كانت باردة. وزارة التعليم Ministry of Education 2024-1446 32

الذائبية Solubilitys تعرّف الذائبية على أنها أقصى كمية من المذاب يمكن أن تذوب في كمية محددة من المذيب عند درجة حرارة معينة. وكما يمكن فهم الذوبان على مستوى الجسيمات، يمكن كذلك فهم الذائبية على مستوى الجسيمات. تعتمد ذائبية المذاب على طبيعة كل من المذاب والمذيب؛ فعند إضافة المذاب إلى المذيب تتصادم جسيمات المذيب مع جسيمات سطح المذاب، وتبدأ جسيمات المذاب الذائبة في الاختلاط خلال جسيمات المذيب عشوائيا . إلا أنه مع زيادة عدد جسيمات المذاب الذائبة يزداد عدد تصادماتها مع بقية البلورة، مما يجعل بعضها يلتصق بسطح البلورة، أو يتبلور مرة أخرى، كما هو موضح في الشكل 13-1. ومع استمرار عملية الذوبان تزداد سرعة التبلور، بينما الشكل 13-1 تُساوي سرعة الذوبان في المحلول تبقى سرعة الذوبان .ثابتة. ويستمر الذوبان ما دامت سرعة الذوبان أعلى المشبع سرعة التبلور، لذلك لا تتغير كمية المذاب. من سرعة التبلور. تجربة منحنى الذائبية ارجع إلى دليل التجارب العملية على منصة عين الإثرائية واعتمادًا على كمية المذاب، قد تتساوى سرعة الذوبان والتبلور في النهاية. وعند هذه النقطة لا يذوب المزيد من المذاب ويصل المحلول إلى حالة من عملية الاتزان الديناميكي بين التبلور والذوبان إذا بقيت درجة الحرارة ثابتة. المحلول غير المشبع يحتوي المحلول غير المشبع على كمية مذاب أقل مما في المحلول المشبع عند درجة حرارة وضغط معينين. أي أنه يمكن إضافة كميات أكبر من المذاب إلى المحلول غير المشبع. المحلول المشبع رغم استمرار ذوبان جسيمات المذاب وتبلورها في المحلول الشكل 14-1 يبين الرسم البياني أدناه منحنى الذي وصل إلى حالة الاتزان إلا أنّ كمية المذاب الذائبة في المحلول تبقى ذائبية عدة مواد عند درجات حرارة مختلفة . .ثابتة. ويعرف مثل هذا المحلول الموضح في الشكل 13-1 بالمحلول المشبع، وهو يحتوي على أكبر كمية من المذاب ذائبة في كمية محددة من المذيب عند درجة حرارة وضغط معينين. درجة الحرارة والمحاليل فوق المشبعة تتأثر الذائبية بارتفاع درجة حرارة المذيب؛ حيث تزداد طاقة حركة جسيماته، فتزداد التصادمات ذات الطاقة الكبيرة مقارنة بالتصادمات عند درجة حرارة منخفضة. إن ذائبية الكثير من المواد أكبر عند درجات الحرارة المرتفعة، كما في الشكل 14-1. فذائبية كلوريد الكالسيوم CaCl2 تساوي 648 لكل 100g من H2O عند درجة حرارة 10 ، وعند زيادة درجة الحرارة إلى 27°C تزداد الذائبية بنسبة 50% تقريبًا : g Cale 100 لكل g H20 100 تقريبًا. تقل ذائبية بعض المواد ومنها كبريتات السيريوم - عند زيادة درجة الحرارة، ولكنها تبقى ثابتة بعد الوصول إلى درجة حرارة معينة. الذائبية بدلالة درجة الحرارة (عدد جرامات المذاب g 100 من المذيب) 100 90 CaCl2 80 70 60 KCI 50 40 30 -NaCl- 320 110 0 KCI03 Cе2(SO4)3 0 10 20 30 40 50 60 70 80 90 100 درجة الحرارة C° اختبار الرسم البياني حدد ذائبية NaCl عند درجة حـــــــــرارة C° 80 . 33 وزار سليم Ministry of Education 2024-1446

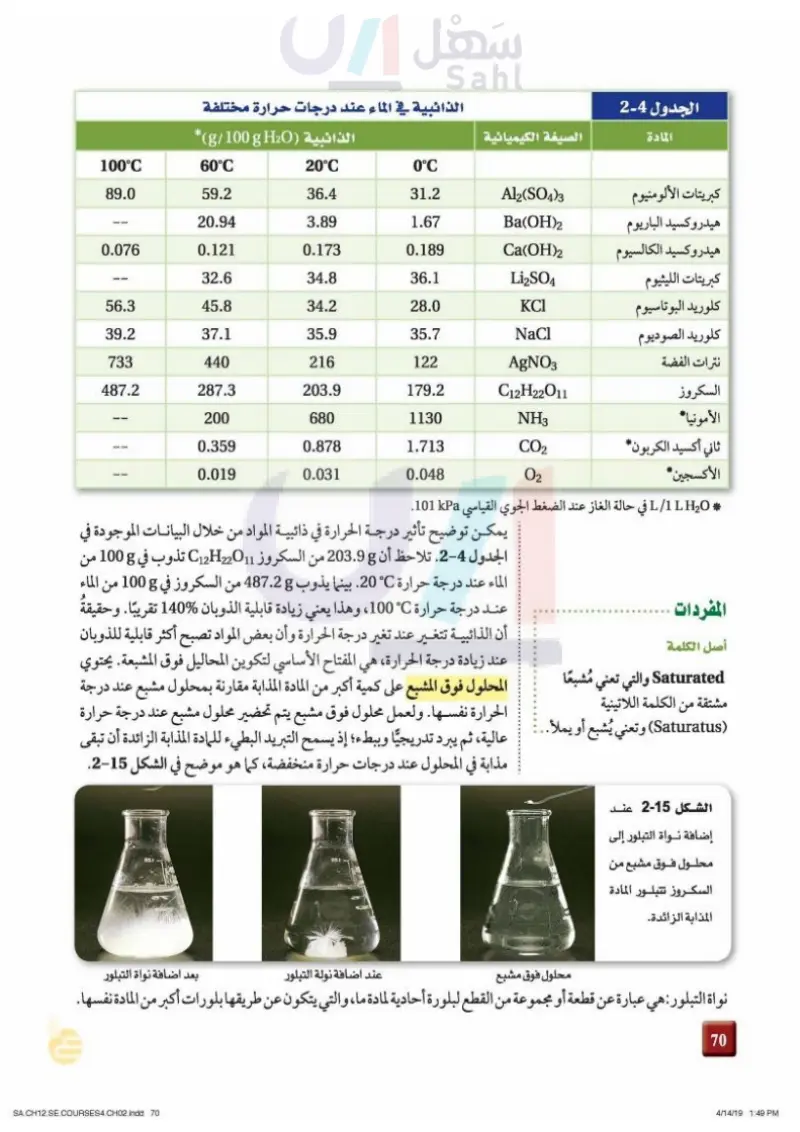
الجدول 4-1 المادة كبريتات الألومنيوم هيدروكسيد الباريوم هيدروكسيد الكالسيوم كبريتات الليثيوم كلوريد البوتاسيوم كلوريد الصوديوم نترات الفضة السكروز الأمونيا ثاني أكسيد الكربون الأكسجين الذائبية في الماء عند درجات حرارة مختلفة *(g/100 g H2O) ALLIAN الصيغة الكيميائية 100°C 60°C 20°C 0°C 89.0 59.2 36.4 31.2 Al2(SO4)3 20.94 3.89 1.67 Ba(OH)2 0.076 0.121 0.173 0.189 Ca(OH)2 32.6 34.8 36.1 Li₂SO4 56.3 45.8 34.2 28.0 KCl 39.2 37.1 35.9 35.7 NaCl 733 440 216 122 AgNO3 487.2 287.3 203.9 179.2 C12H22O11 200 680 1130 NH3 0.359 0.878 1.713 CO2 0.019 0.031 0.048 02 * L / H2O في حالة الغاز عند الضغط الجوي القياسي kPa 101. المفردات أصل الكلمة يمكن توضيح تأثير درجة الحرارة في ذائبية المواد من خلال البيانات الموجودة في الجدول 4-1 تلاحظ أن g 203.9 من السكروز C2H22011 تذوب في 8 100 من الماء عند درجة حرارة 20°C. بينما يذوب 487.28 من السكروز في 100g من الماء عند درجة حرارة C° 100، وهذا يعني زيادة قابلية الذوبان %140 تقريبًا. وحقيقةُ أن الذائبية تتغير عند تغير درجة الحرارة وأن بعض المواد تصبح أكثر قابلية للذوبان عند زيادة درجة الحرارة، هي المفتاح الأساسي لتكوين المحاليل فوق المشبعة. يحتوي Saturated والتي تعني مُشبعا المحلول فوق المشبع على كمية أكبر من المادة المذابة مقارنة بمحلول مشبع عند درجة الحرارة نفسها. ولعمل محلول فوق مشبع يتم تحضير محلول مشبع عند درجة حرارة مشتقة من الكلمة اللاتينية (Saturatus) وتعني يُشبع أو يملأ . عالية، ثم يبرد تدريجيًا وببطء؛ إذ يسمح التبريد البطيء للمادة المذابة الزائدة أن تبقى مذابة في المحلول عند درجات حرارة منخفضة، كما هو موضح في الشكل 115 الشكل 15-1 عند إضافة نواة التبلور إلى محلول فوق مشبع من السكروز تتبلور المادة المذابة الزائدة محلول فوق مشبع عند اضافة نولة التبلور بعد اضافة نواة التبلور نواة التبلور : هي عبارة عن قطعة أو مجموعة من القطع لبلورة أحادية لمادة ما، والتي يتكون عن طريقها بلورات أكبر من المادة نفسها. 34 وزارة التعليم Ministry of Education 2024-1446

الشكل 1-1 الرواسب المعدنية في الينابيع الحارة مثل ( عيون الليث في المملكة العربية السعودية) تعتبر مثال على تكون البلورات من المحاليل فوق المشبعة . المحاليل فوق المشبعة غير ثابتة؛ فعند إضافة قطعة صغيرة جدا من مذاب ـ تسمى نواة التبلور - إلى محلول فوق مشبع تترسب المادة المذابة الزائدة بسرعة، كما هو الكيمياء في واقع الحياة موضح في الشكل 15-1. الاستمطار في السعودية العربية السعودية واحدة من تجارب عدة قامت في دول عربية مختلفة، ويمكن أن يحدث التبلور عند كشط (Scratch) الجزء الداخلي من الكأس تعد تجارب الاستمطار في المملكة الزجاجية أو الوعاء الزجاجي المحتوي على المحلول بساق تحريك زجاجية بلطف أو تعرُّض المحلول فوق المشبع للحركة أو الرج. وباستعمال يوديد الفضة AgTI بوصفه نوى تكثف في الهواء فوق المشبع ببخار الماء حيث أجريت لأول مرة عام 1988م تتجمع جزيئات الماء في صورة قطيرات قد تسقط على الأرض على هيئة مطر. في منطقة عسير، بينما أجريت التجربة تسمى هذه الآلية استمطار الغيوم. كما يتكون سكر النبات Rock Candy الثانية عام 2006م في ثلاث مناطق والرواسب المعدنية على حواف الينابيع المعدنية - كالتي تظهر في الشكل 16-1 وسط المملكة (الرياض، والقصيم، من محاليل فوق مشبعة. وحائل). المفردات الضغط Pressure ذائبية الغازات تقل ذائبية غازي الأكسجين وثاني أكسيد الكربون عند درجات الحرارة المرتفعة مقارنة بدرجات الحرارة المنخفضة. وهذا سلوك متوقع لجميع المواد الغازية المذابة في المذيبات السائلة. هل تستطيع تفسير هذا السلوك؟ تذكر أن الطاقة الحركية لجسيمات الغاز تسمح للجسيمات بالتحرر أو النفاد من المحلول الاستعمال العلمي مقابل بسهولة أكبر عند درجات الحرارة المرتفعة. ولذلك كلما زادت درجة حرارة الاستعمال الشائع المحلول قلت ذائبية المذاب الغازي. الضغط وقانون هنري يؤثر الضغط في ذائبية المواد الغازية المذابة في المحاليل؛ الاستعمال العلمي: القوة المبذولة على وحدة المساحة. فكلما ازداد الضغط فوق المحلول زادت ذائبية الغاز في أي مذيب. تعتمد المشروبات خلال تسرب غاز ثاني أكسيد الغازية على هذا المبدأ؛ فهي تحتوي على غاز ثاني أكسيد الكربون المذاب في محلول مائي تحت ضغط أعلى من الضغط الجوي، وعند فتح علبة المشروب الغازي يكون داخل القارورة المغلقة. ضغط غاز ثاني أكسيد الكربون داخل العلبة أعلى من الضغط الواقع خارج العلبة. الاستعمال الشائع: الجهد الفيزيائي ونتيجة لذلك تتصاعد فقاعات غاز ثاني أكسيد الكربون من المحلول إلى السطح أو الإجهاد الذهني. وتتطاير. وتستمر هذه العملية حتى يفقد المحلول غاز ثاني أكسيد الكربون كله يقع على الطلاب الكثير من الضغط تقريبًا، ويصبح المحلول بلا طعم. ويمكن وصف انخفاض ذائبية غاز ثاني أكسيد في أثناء الاختبارات. الكربون في المشروب الغازي بعد فتح العبوة بقانون هنري. الكربون من المحلول يزداد الضغط 35 وزارة سليم Ministry of Education 2024-1446

الاستمطار في السعودية
المفردات الضغط
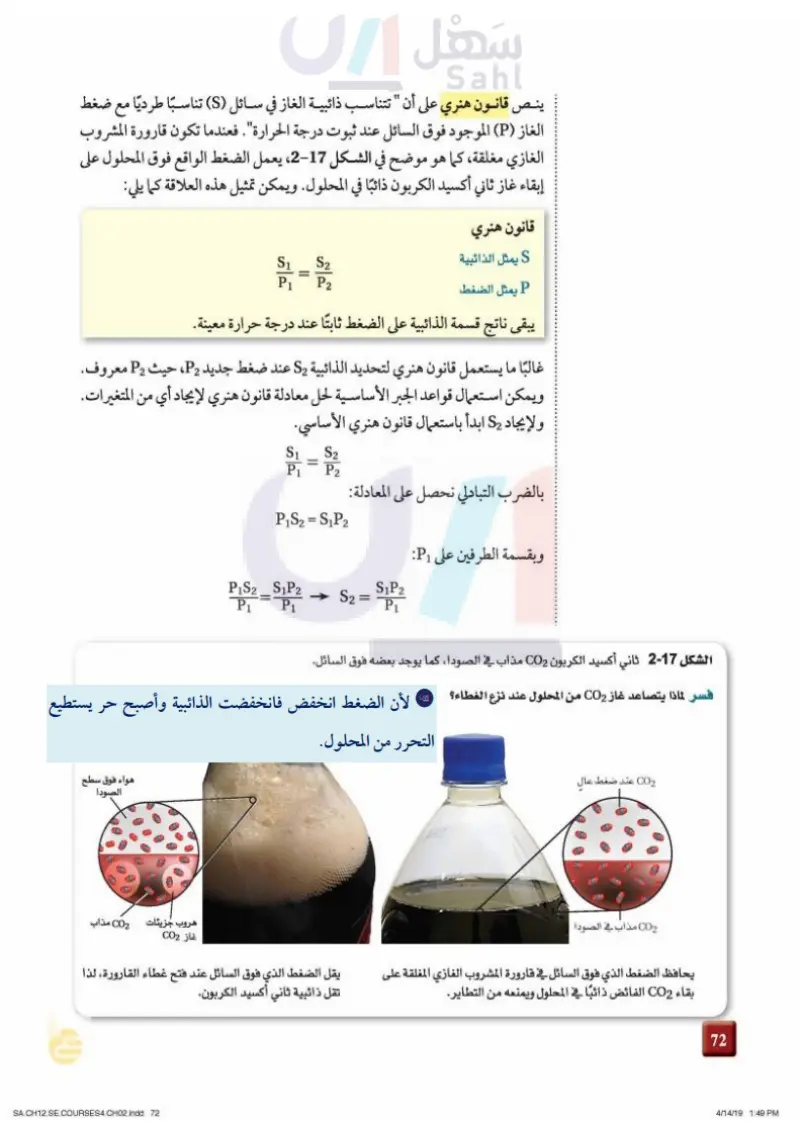
36 ينص قانون هنري على أن " تتناسب ذائبية الغاز في سائل (S) تناسبًا طرديًا مع ضغط الغاز (P) الموجود فوق السائل عند ثبوت درجة الحرارة. فعندما تكون قارورة المشروب الغازي مغلقة، كما هو موضح في الشكل 17-1، يعمل الضغط الواقع فوق المحلول على إبقاء غاز ثاني أكسيد الكربون ذائبًا في المحلول. ويمكن تمثيل هذه العلاقة كما يلي: قانون هنري S يمثل الذائبية P يمثل الضغط S2 P2 = S1 P1 يبقى ناتج قسمة الذائبية على الضغط ثابتًا عند درجة حرارة معينة. غالبًا ما يستعمل قانون هنري لتحديد الذائبية - عند ضغط جديد P2، حيث P2 معروف. ويمكن استعمال قواعد الجبر الأساسية لحل معادلة قانون هنري لإيجاد أي من المتغيرات. و لإيجاد S2 ابدأ باستعمال قانون هنري الأساسي. بالضرب التبادلي نحصل على المعادلة: S1 P1 = S2 P2 PS2 = SP2 وبقسمة الطرفين على : SP2 S₁P2 S2 = P1 P₁ الشكل 17-1 ثاني أكسيد الكربون CO2 مذاب في الصودا ، كما يوجد بعضه فوق السائل. فسر لماذا يتصاعد غاز CO2 من المحلول عند نزع الغطاء؟ CO2 عند ضغط عال CO2 مذاب في الصودا PS2 P1 = هروب جزيئات غاز CO2 هواء فوق سطح الصودا CO2 مذاب يحافظ الضغط الذي فوق السائل في قارورة المشروب الغازي المغلقة على بقاء CO2 الفائض ذائبًا في المحلول ويمنعه من التطاير. يقل الضغط الذي فوق السائل عند فتح غطاء القارورة، لذا تقل ذائبية ثاني أكسيد الكربون. وزارة التعليم Ministry of Education 2024-1446

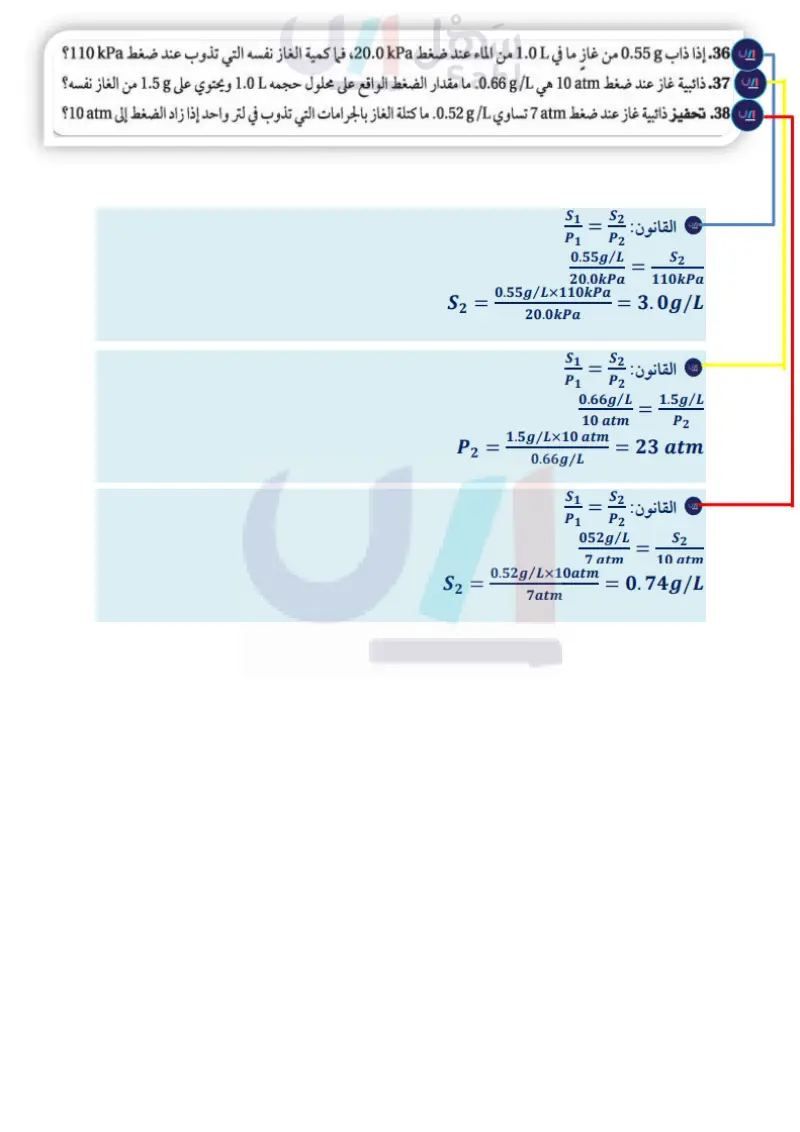
مثال 5-1 قانون هنري إذا ذاب g 0.85 من غاز ما عند ضغط مقداره atm 4.0 في 1.0L من الماء عند درجة حرارة C° 25، فكم يذوب منه في 1.0L من الماء عند ضغط مقداره atm 1.0 ودرجة الحرارة نفسها؟ 1 تحليل المسألة أعطيت ذائبية الغاز عند الضغط الابتدائي، وثبات درجة حرارة الغاز مع تغير الضغط. ولأن تقليل الضغط يؤدي إلى تقليل ذائبية الغاز فإن كتلةً أقل من الغاز تذوب عند ضغط أقل. المعطيات المطلوب S2 = ? g/L S1 = 0.85 g/L P1 = 4.0 atm P2 = 1.0 atm 2 حساب المطلوب اكتب قانون هنري حل قانون هنري لإيجاد S2 عوض P2 = 1.0 atm، P1 = 4.0 atm، S1 = 0.85 g/L ثم اضرب واقسم الأرقام والوحدات. 3 تقويم الإجابة S1 P1 S2 = = S2 P2 S1 P Pi S2 = 0.85 g 1.0 atm 4.0 atm 1.0 L 0.21 g/L قلت الذائبية، كما هو متوقع ؛ فقد قل الضغط فوق المحلول من atm 4.0 إلى atm 1.0 ، لذا يجب أن تنخفض الذائبية إلى ربع قيمتها الأصلية الوحدة g/L هي وحدة الذائبية. مسائل تدريبية 36. إذا ذاب g 0.55 من غاز ما في 1.0L من الماء عند ضغط 20.0kPa ، فما كمية الغاز نفسه التي تذوب عند ضغط 110kPa؟ 37. ذائبية غاز عند ضغط atm 10 g/L 0.66. ما مقدار الضغط الواقع على محلول حجمه 1.0L ويحتوي على 1.58 من الغاز نفسه؟ 38. تحفيز ذائبية غاز عند ضغط 7atm تساوي 0.52 . ما كتلة الغاز بالجرامات التي تذوب في لتر واحد إذا زاد الضغط إلى atm 10؟ هي g التقويم 3-1 الخلاصة 39. الفكرة الرئيسة عدد العوامل المؤثرة في الذوبان. تتضمن عملية الذوبان إحاطة 40. عرف الذائبية. جسيمات المذيب الجسيمات المذاب. 41. اشرح كيف تؤثر قوى التجاذب بين الجزيئات في الذوبان؟ يكون المحلول غير مشبع أو مشبعا .42. قارن كيف تتشابه طريقة تحضير محلول مائي من ملح الطعام، ومحلول مائي من السكر؟ أو فوق مشبع. 43. لخص ماذا يحدث إذا أضيفت نواة تبلور إلى محلول فوق مشبع ؟ وبم تصف المحلول الناتج ؟ و ينص قانون هنري على أن ذائبية 44. الرسوم الغاز في سائل تتناسب طرديا بيانية لذائبية كبريتات الألومنيوم، وكبريتات الليثيوم، وكلوريد البوتاسيوم عند ضغط الغاز فوق السائل عند درجات حرارة 0°C و 20°C و 60°C و 100°C . أي المواد السابقة تتأثر ذائبيتها م البيانية استعمل المعلومات الموجودة في الجدول 4-1 لعمل رسوم مع درجة حرارة معينة. أكثر بزيادة درجة الحرارة؟ 37 وزارة سليم Ministry of Education 2024-1446

خلاصة درس العوامل المؤثرة في الذوبان
إذا ذاب 0.55g من غاز ما في 1.0L من الماء عند ضغط 20.0kpa، فما كمية الغاز نفسه التي تذوب عند ضغط kPa 110


عرف الذائبية



 0
0 

 0
0