نظرية الكم والذرة - الكيمياء2-1 - ثاني ثانوي
الفصل1: الحسابات الكيميائية
الفصل2: الإلكترونات في الذرات
الفصل3: الجدول الدوري والتدرج في خواص العناصر
الفصل4: المركبات الأيونية والفلزات
2-2 رابط الدرس الرقمي الأهداف نظرية الكم والذرة www.ien.edu.sa تقارن بين نموذج بور Quantum Theory and the Atom ) والنموذج الميكانيكي الكمي الفكرة الرئيسة تساعدك الخصائص الموجية للإلكترونات على الربط بين طيف للذرة. الانبعاث الذري وطاقة الذرة ومستويات الطاقة. توضح تأثير كل من الطبيعة الربط مع الحياة تصور أنك ترتقي سلما، هل تستطيع الوقوف بين درجاته بكلتا رجليك؟ إنك الموجية – الجسيمية لدي برولي لا تستطيع فعل ذلك؛ لأنك لا تقدر على الوقوف في الهواء. وهذا يشبه ما تقوم به الإلكترونات ومبدأ الشك لهايزنبرج في في مستويات الطاقة في الذرات. النظرة الحالية للإلكترونات في الذرة. نموذج بور للذرة Bohr's Model of the Atom تعرف العلاقة بين مستويات فسَّر نموذج الطبيعة الموجية - الجسيمية للضوء العديد من الظواهر المتخصصة، ولكن بقي الطاقة الرئيسة والمستويات العلماء غير قادرين على فهم العلاقات بين البناء الذري، والإلكترونات، وطيف الانبعاث الثانوية والمستويات الفرعية الذري. تذكر مما سبق أن طيف الانبعاث الذري للهيدروجين منفصل؛ أي يتكون من ترددات لذرة الهيدروجين. مراجعة المفردات محددة من الضوء. لماذا يكون طيف الانبعاث الذري للعناصر منفصلا وليس متصلا؟ طاقة ذرة الهيدروجين استفاد العالم نيلز بور من أفكار العالمين بلانك وأينشتاين، واقترح أن لذرة الهيدروجين مستويات طاقة معينة يسمح للإلكترونات أن توجد فيها. وتسمى الحالة التي الذرة: أصغر جزء من تكون إلكترونات الذرة فيها أدنى طاقة حالة الاستقرار أما عندما تكتسب إلكترونات الذرة العنصر يحتفظ بجميع خواصه الطاقة فتصبح في حالة إثارة. وتتكون من الإلكترونات والبروتونات والنيوترونات. المفردات الجديدة حالة الاستقرار حالة الإثارة العدد الكمي مبدأ الشك لهايزنبرج النموذج الميكانيكي الكمي للذرة المستوى العدد الكمي الرئيس مستوى الطاقة الرئيس مستوى الطاقة الثانوي كما ربط بور أيضًا بين مستويات الطاقة لذرة الهيدروجين والإلكترون داخلها. واقترح أن الإلكترون في ذرة الهيدروجين يتحرك حول النواة في مدارات دائرية مسموح بها فقط. وكلما صغر مدار الإلكترون قلت طاقته أو قل مستوى الطاقة. وعلى العكس من ذلك، كلما كبر مدار الإلكترون زادت طاقة الذرة أو زاد مستوى الطاقة. وبناءً على ذلك، فإن لذرة الهيدروجين حالات إثارة كثيرة، رغم أنها تحتوي على إلكترون واحد. والشكل 10-2 يوضح أفكار العالم بور. الشكل 10-2 يوضح ذرة تحتوي على إلكترون واحد ، يوجد في حالته المستقرة في المستوى الأقل طاقة، وعندما تكون الذرة في حالة إثارة يكون الإلكترون في مستوى طاقة أعلى. إلكترون نواة إلكترون نواة 78 حالة الإثارة حالة الاستقرار وزارة التعليم Ministry of Education 2024-1446

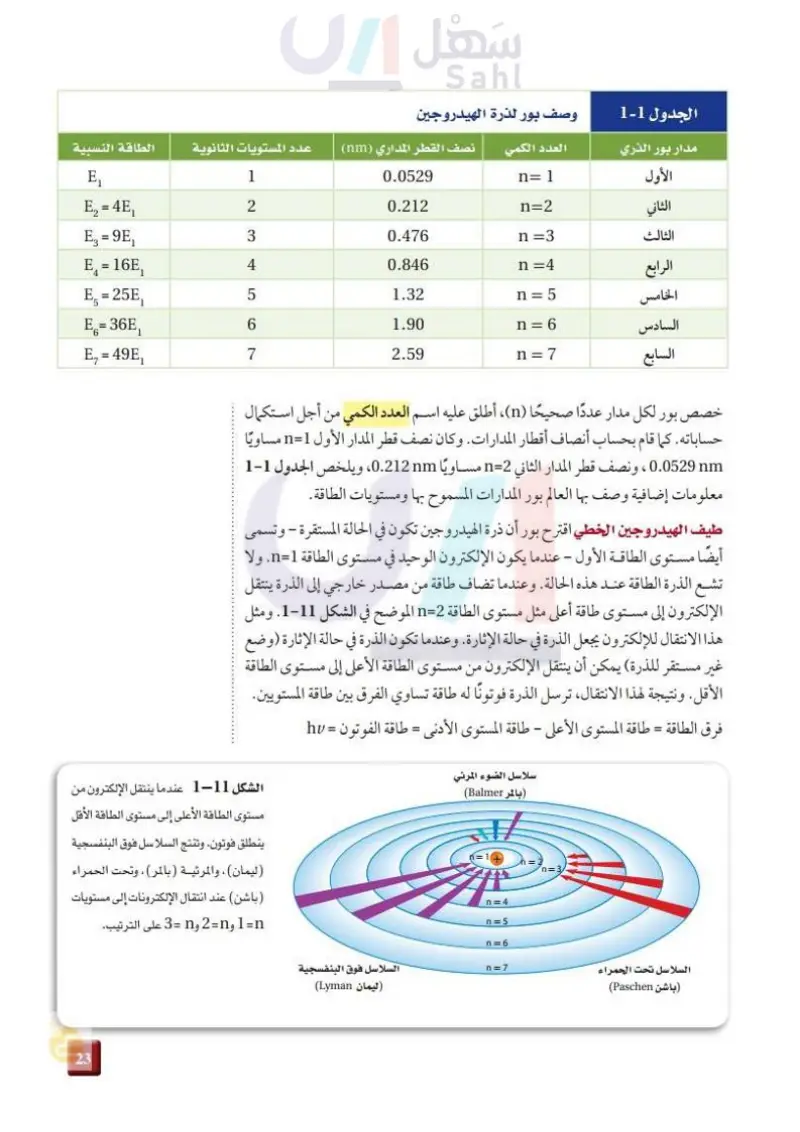
الجدول 1-2 وصف بور لذرة الهيدروجين مدار بور الذري الأول العدد الكمي نصف القطر المداري (nm) عدد المستويات الثانوية الطاقة النسبية الثاني الثالث الرابع الخامس السادس السابع E, 1 0.0529 n=1 E₂ = 4E₁ 2 0.212 n=2 E₁ = 9E₁ 3 0.476 n =3 E, = 16E, 4 0.846 n =4 E₁ = 25E₁ LO 5 1.32 n = 5 E6= 36E₁ 6 1.90 n = 6 E₁ = 49E₁ له 7 2.59 n =7 خصص بور لكل مدار عددًا صحيحًا (n)، أطلق عليه اسم العدد الكمي من أجل استكمال حساباته. كما قام بحساب أنصاف أقطار المدارات. وكان نصف قطر المدار الأول 1=n مساويًا 0.0529nm ، ونصف قطر المدار الثاني 2=n مساويًا 0.212nm ، ويلخص الجدول 1-2 معلومات إضافية وصف بها العالم بور المدارات المسموح بها ومستويات الطاقة. طيف الهيدروجين الخطي اقترح بور أن ذرة الهيدروجين تكون في الحالة المستقرة – وتسمى أيضًا مستوى الطاقة الأول - عندما يكون الإلكترون الوحيد في مستوى الطاقة 1=n. ولا تشع الذرة الطاقة عند هذه الحالة. وعندما تضاف طاقة من مصدر خارجي إلى الذرة ينتقل الإلكترون إلى مستوى طاقة أعلى مثل مستوى الطاقة 2=n الموضح في الشكل 11-2. ومثل هذا الانتقال للإلكترون يجعل الذرة في حالة الإثارة. وعندما تكون الذرة في حالة الإثارة (وضع غير مستقر للذرة) يمكن أن ينتقل الإلكترون من مستوى الطاقة الأعلى إلى مستوى الطاقة الأقل. ونتيجة لهذا الانتقال ترسل الذرة فوتونا له طاقة تساوي الفرق بين طاقة المستويين. فرق الطاقة - طاقة المستوى الأعلى - طاقة المستوى الأدنى = طاقة الفوتون = hf = سلاسل الضوء المرئي (بالمرBalmer) 6 = 10 h = 2 n=3 n=4 n=5 n = 6 الشكل 11-2 عندما ينتقل الإلكترون من مستوى الطاقة الأعلى إلى مستوى الطاقة الأقل ينطلق فوتون. وتنتج السلاسل فوق البنفسجية ليمان) ، والمرئية (بالمر)، وتحت الحمراء ( باشن) عند انتقال الإلكترونات إلى مستويات n= 1 وn=2 وn = 3 على الترتيب. السلاسل تحت الحمراء (باشن Paschen) n = 7 السلاسل فوق البنفسجية ليمان Lyman) 79 واصل عليم Ministry of Education 2024-1446

طاقة ذرة الهيدروجين 5865 4 3 2 1 يمكنك مقارنة مستويات الطاقة لذرة الهيدروجين بدرجات السلم. حيث يمكن للشخص أن يصعد أو يهبط من درجة إلى أخرى. وكذلك حــــال إلكترون ذرة الهيدروجين؛ حيث يمكنه الانتقال فقط من مستوى مسموح به إلى آخر. ولذا يمكن أن تنبعث أو تُمتص كميات معينة من الطاقة تساوي فرق الطاقة بين المستويين. يوضح الشكل 12- أن مستويات الطاقة في ذرة الهيدروجين لا يبعد بعضها عن بعض مسافات متساوية، وذلك بخلاف درجات السلم. كما يوضح هذا الشكل أيضًا تنقلات الإلكترون الأربعة التي تنتج الخطوط المرئية في طيف الانبعاث الذري لذرة الهيدروجين، ويُنتج انتقال الإلكترون من مستويات الطاقة العليا إلى المستوى الثاني 2=n خطوط الهيدروجين المرئية كلها، والتي تشكل سلسلة بالمر. وكما قيست طاقة انتقال الإلكترون في المنطقة غير المرئية، مثل سلسلة ليمان (فوق البنفسجية) التي ينتقل فيها الإلكترون إلى المستوى 1 =n ، وكذلك سلسلة باشن (تحت الحمراء)، التي تنتج عن انتقال الإلكترون إلى المستوى 3= n. ماذا قرأت ؟ وضح لماذا ينتج عن سلوك الإلكترون في الذرة ألوان مختلفة للضوء؟ حدود نموذج بور فسّر نموذج بور الطيف المرئي للهيدروجين، إلا أنه لم يستطع تفسير طيف أي عنصر آخر، كما أنه لم يفسر السلوك الكيميائي للذرات. وعلى الرغم من أن فكرة بور عن ذرة الهيدروجين وضعت الأساس للنماذج الذرية اللاحقة، إلا أن التجارب اللاحقة أوضحت خطأ نموذج بور بشكل أساسي؛ إذ لم تفهم حركة الإلكترونات في الذرات بصورة تامة حتى الآن، وهناك أدلة تؤكد أن الإلكترونات لا تتحرك حول النواة في مدارات دائرية. وزارة التعليم Ministry of Education 2024-1446 الشكل 12-2 مستويات الطاقة مشابهة لدرجات السلم. وتمثل الخطوط المرئية الأربعة عودة الإلكترون من المستويات (n) الأعلى إلى المستوى 2 = n وكلما زادت قيمة n، اقتربت مستويات طاقة الذرة أكثر بعضها من بعض. 80

النموذج الميكانيكي الكمي للذرة The Quantum Mechanical Model of the Atom تجربة عملية نسبة شحنة الإلكترون إلى كتلته اقتنع العلماء في منتصف القرن العشرين أن نموذج بور للذرة غير صحيح، فوضعوا تصورات ارجع إلى دليل التجارب العملية على منصة جديدة ومبتكرة تبين كيف تتوزع الإلكترونات في الذرات. ففي عام 1924م اقترح أحد طلاب الدراسات العليا في الفيزياء - اسمه لوي دي برولي Dogle 1987-1892م) - فكرة أدت إلى تفسير مستويات الطاقة الثابتة في نموذج بور. الإلكترونات موجات اعتقد دي برولي أن للجسيمات المتحركة خواص الموجات. وقد عرف دي برولي أنه إذا كان للإلكترون حركة الموجة وكان مقيدًا بمدارات دائرية أنصاف أقطارها ثابتة، فإنه يستطيع إشعاع موجات ذات أطوال موجية وسرعات وطاقات معينة فقط. وبتطوير فكرته اشتق دي برولي المعادلة الآتية: العلاقة بين الجسيم والموجة الكهرومغناطيسية عين الإثرائية ۸ = h/m.v تمثل طول الموجة h ثابت بلانك m تمثل كتلة الجسيمات تمثل السرعة طول موجة الجسيم هي النسبة بين ثابت بلانك، وناتج ضرب كتلة الجسيم في سرعته. مختبر حل المشكلات تفسير الرسوم العلمية ما تنقلات الإلكترون التي تفسر سلسلة بالمر؟ يتكون طيف انبعاث الهيدروجين من ثلاث سلاسل من الخطوط. فبعض الأطوال الموجية فوق بنفسجية ( سلسلة ليمان)، وبعضها الآخر تحت حمراء (سلسلة باشن)، وتشكل الأطوال الموجية المرئية HB Ha H Hy حدود السلسة 4000 5000 6000 7000 λ (Å) سلسلة بالمر. يعزو نموذج بور الذري هذه الخطوط الطيفية إلى التفكير الناقد انتقال إلكترون من مستويات الطاقة العليا التي تكون فيها 1. احسب الطول الموجي لانتقال الإلكترون بين n = n إلى مستويات الطاقة المنخفضة التي يكون فيها n = n. التحليل توضح الصورة على الجهة اليسرى بعض تنقلات الإلكترون في سلسلة بالمــر للهيدروجين. وتسمى هذه الخطوط المدارات: a. n = 3; n, = 2 n;= b. n₁ = 4; n₁ = 2 c.n₁ = 5; n = 2 d.n = 6; n = 2 .Hɛ (4101 Å) .Hy (4340 Å).HB (4861 Å).Ha (6562 Å) 2. اربط بين الطول الموجي في سلسلة بالمر، والتي وكل طول موجة (۸) مرتبط مع انتقال إلكترون ضمن ذرة الهيدروجين من خلال المعادلة الآتية التي يمثل فيها القيمة: 1 - m 107× 1.09678 ثابت ريد برج. 1/ X = 1.09678 × 107 (+12=-12) m1 n n² حسبتها في السؤال 1 ، والقيم المحسوبة تجريبيا. وهل تتوافق أطوال الموجات مع الأخذ بعين الاعتبار خطأ التجربة وعدم دقة الحسابات؟ وضح إجابتك. واحد إنجستروم (A) يساوي 10-10m. وتحدث في سلسلة بالمر انتقالات الإلكترون من المستويات 3. طبق معادلة / = E لتحديد طاقة الكم لكل العليا إلى المستوى 2=n، وهذا يعني أن 2 = n. انتقال في السؤال 1. 81 وزارفن عليم Ministry of Education 2024-1446

X X إلكترون السرعة = 0 قبل التصادم يزداد الطول الموجي للفوتون تزداد سرعة الإلكترون بعد التصادم فوتون λ مبدأ هايزنبرج للشك كشف العلماء - ومنهم رذرفورد Rutherford وبور ودي برولي - خفايا الذرة بالتدريج. إلا أن الاستنتاج الذي توصل إليه عالم الفيزياء النظرية هايزنبرج Hisenberg (1901- 1976م) كان له آثاره الكبيرة في النماذج الذرية. أوضح هايزنبرج أنه من المستحيل أن تأخذ أي قياسات لجسم ما دون التأثير فيه. فعلى سبيل المثال، تصور محاولة إيجاد موقع بالون متنقل مليء بغاز الهيليوم في غرفة مظلمة، فإذا حركت يدك تستطيع أن تحدد موقع البالون عندما تلمسه، إلا أنك عندما تلمس البالون تنقل إليه طاقة وتغير مكانه. وتستطيع أيضًا أن تحدد مكان البالون بإضاءة مصباح يدوي وباستخدام هذه الطريقة تنعكس فوتونات الضوء من البالون وتصل إلى عينيك محدّدةً مكان البالون. ولأن البالون جسم كبير نسبيا، لذا يكون تأثير الفوتونات المنعكس عنه على موقعه صغيرًا جدًا وغير ملاحظ. ولكن تصور محاولة تحديد مكان الإلكترون باصطدامه مع فوتون عالي الطاقة. ولأن للفوتون طاقة مماثلة لطاقة الإلكترون نفسه، لذا فإن التصادم بين الجسمين يغير كلا من الطول الموجي للفوتون وموقع الإلكترون وسرعته المتجهة، كما في الشكل ،13-2، أي أنه يحدث تغير لا يمكن تجاهله في مكان الإلكترون وحركته. لقد أدى تحليل هايزنبرج لمثل تلك التصادمات بين الفوتونات والإلكترونات إلى الشكل 13- عندما يصطدم فوتون استنتاجه التاريخي، وهو "مبدأ هايزنبرج للشك" الذي ينص على أنه من المستحيل مع إلكترون ساكن تتغير كل من سرعة معرفة سرعة جسيم ومكانه في الوقت نفسه بدقة. الإلكترون ومكانه. وهذا يوضح مبدأ هايزنبرج للشك. فمن المستحيل أن نعرف ماذا قرأت؟ وضح مبدأ هايزنبرج للشك. مكان الجسيم وسرعته في الوقت نفسه. وعلى الرغم من أن العلماء قد وجدوا مبدأ هايزنبرج في تلك الحقبة صعب القبول، فسر لماذا تتغير طاقة الفوتون؟ إلا أنه أثبت أنه يصف المحدّدات الأساسية لما يمكن ملاحظته؛ فتأثير تصادم الفوتون بالجسم الكبير - مثل البالون المليء بالهيليوم - قليل، بحيث إن الشك في موقعه أصغر من أن يقاس. ولكن هذه الحالة لا تشبه إلكتروناً يتحرك بسرعة m/s 106× 6 قرب النواة. فعدم التحديد أو الشك في مكان الإلكترون هو على الأقل 10m، وهذا أكبر 10 مرات تقريبًا من قطر الذرة. ويعني مبدأ هايزنبرج للشك أيضًا أنه من المستحيل تحديد مسارات ثابتة للإلكترونات مثل المدارات الدائرية في نموذج بور، وأن الكمية الوحيدة التي يمكن معرفتها هي المكان الذي يحتمل أن يوجد فيه إلكترون حول النواة. 82 82 وزارة التعليم Ministry of Education 2024-1446

معادلة شرودنجر الموجية في عام 1926م تابع الفيزيائي النمساوي إيروين شرودنجر Schrodinger (1887 - 1961م) نظرية الموجة – الجسيم التي اقترحها دي برولي، واشتق شرودنجر معادلة على اعتبار أن إلكترون ذرة الهيدروجين موجة. وظهر أن نموذج شرودنجر لذرة الهيدروجين ينطبق جيدًا على ذرات العناصر الأخرى، وهو ما فشل نموذج بور في تحقيقه . ويسمى النموذج الذري الذي يعامل الإلكترونات على أنها موجات بالنموذج الموجي الميكانيكي للذرة أو النموذج الميكانيكي الكمي للذرة. وكما هو الحال في نموذج بور، يحدد النموذج الميكانيكي الكمي طاقة الإلكترون بقيم معينة، إلا أنه – بخلاف نموذج بور – لا يحاول وصف مسار الإلكترون حول النواة. ماذا قرأت؟ قارن بين نموذج بور والنموذج الميكانيكي الكمي للذرة. أعتبر كل حل المعادلة شرودنجر يمثل دالة موجية ، ترتبط مع احتمال وجود الإلكترون ضمن حجم معين من الفراغ حول النواة. تذكّر من خلال دراستك للرياضيات أن حادثة ما ذات احتمال عال تكون أكثر قابلية للحدوث من الحادثة ذات الاحتمال المنخفض. موقع الإلكترون المحتمل تتنبأ دالة الموجة بمنطقة ثلاثية الأبعاد للإلكترون حول النواة تُسمى المستوى، وهو يصف الموقع المحتمل لوجود إلكترون. يشبه المستوى الفرعي سحابة تتناسب كثافتها عند نقطة معينة مع احتمال وجود الإلكترون عند تلك النقطة. ويوضح الشكل 14- خريطة الكثافة الإلكترونية (السحابة الإلكترونية) التي تصف الإلكترون في مستوى الطاقة الأدنى ، كما أنها تُعد صورة لحظية لحركة الإلكترون حول النواة، حيث تمثل كل نقطة فيها موقع الإلكترون عند لحظة معينة من الوقت. وتمثل الكثافة العالية للنقاط قرب النواة احتمالا كبيرًا لوجود الإلكترون في هذا الموقع إلا أنه - بسبب عدم وجود حدود ثابتة للسحابة - من الممكن أيضًا أن يوجد الإلكترون على مسافة أبعد من النواة. a ماذا قرأت ؟ صف أين توجد الإلكترونات في ذرة ما ؟ النواة b الحد • . . خريطة الكثافة الإلكترونية ( السحابة الإلكترونية ) الشكل 14 تمثل خريطة الكثافة احتمال وجود إلكترون في موقع معين حول النواة a. تظهر الكثافة العالية للنقاط قرب النواة أن احتمال وجود الإلكترون قرب النواة كبير جدًّا. b. يحتمل وجود الإلكترون بنسبة 90% ضمن المنطقة الدائرية الظاهرة عند أي لحظة. وأحيانًا يتم اعتبار هذه المنطقة تمثيلاً لحدود = الذرة. وفي هذا الرسم تمثل الدائرة مسقطا ثلاثي الأبعاد لكرة تحتوي على الإلكترونات. 83 وارفت عليم Ministry of Education 2024-1446

الجدول 2-2 مستويات الطاقة الرئيسة مستوى الطاقة عدد الكم الرئيس 1 K 2 L M NOP له 3 ہے 4 5 9 7 Q 2-3 مستويات الطاقة الجدول الثانوية عدد الإلكترونات التي يستوعبها 2 المستوى الثانوي S p 6 d 10 f 14 Hydrogen's Atomic Orbitals مستويات ذرة الهيدروجين لأن حدود المستوى غير واضحة فليس للمستوى حجم ثابت ودقيق. وللتغلب على عدم التحديد المؤكد في موقع الإلكترون يرسم الكيميائيون سطحًا للمستوى يحتوي على %90 من الاحتمال الكلي لوجود الإلكترون. وهذا يعني أن احتمال وجود الإلكترون ضمن هذه الحدود هو 0.9، واحتمال وجوده خارجها هو 0.1. وبعبارة أخرى، فإن احتمال وجود الإلكترون قريبًا من النواة وضمن الحجم المعرف بالحدود أكثر من احتمال وجوده خارج ذلك الحجم. والدائرة في الشكل 14-2- تمثل 90% من مستوى الهيدروجين الأقل طاقة. عدد الكم الرئيس تذكر أن نموذج بور قد عيّن أعداد الكم لمدارات الإلكترون. وعيّن النموذج الكمي بصورة مشابهة أربعة أعداد كم للمستويات الذرية. يعد العدد الأول هو عدد الكم الرئيس (n)، الذي يشير إلى الحجم النسبي وطاقة المستويات؛ إذ كلما ازدادت قيمة n زاد حجم المستوى، لذا يقضي الإلكترون وقتا أكبر بعيدًا عن النواة، وتزداد طاقة الذرة. لذا تحدد n مستويات الطاقة الرئيسة للذرة، ويُسمى كل منها بمستوى الطاقة الرئيس. وقد أعطي مستوى الطاقة الأدنى للذرة عدد كم رئيسي يساوي (1) . وعندما يحتل إلكترون ذرة الهيدروجين الوحيد المستوى 1=n تكون الذرة في الحالة المستقرة. وقد تم تحديد 7 مستويات طاقة لذرة الهيدروجين، أعطيت أعدادًا (n) تتراوح بين 1 و 7. و مستويات الطاقة الثانوية تحتوي مستويات الطاقة الرئيسة على مستويات ثانوية. ويتألف مستوى الطاقة الرئيس 1 من مستوى ثانوي ،واحد ومستوى الطاقة الرئيس 2 من مستويين ثانويين للطاقة، ومستوى الطاقة الرئيس 3 من ثلاثة ومستوى الطاقة الرئيس 3 من ثلاثة مستويات ثانوية، ومستوى الطاقة الرئيس 4 من أربعة مستويات ثانوية ، أما مستويات الطاقة الرئيسة (75) من أربعة مستويات ثانوية كالمستوى الرئيس الرابع. ولمعرفة العلاقة بين مستويات الطاقة الرئيسة والمستويات الثانوية بطريقة أفضل، انظر إلى الشكل 15-2 فكلما ارتفعت إلى أعلى تحتوي الصفوف على مقاعد أكثر. وكذلك يتزايد عدد المستويات الثانوية للطاقة في مستوى الرئيس عندما تزداد قيمة n. الطاقة الشكل 15 يمكن التفكير في مستويات الطاقة وكأنها صفوف المقاعد في هذا المسرح الأثري؛ إذ تحتوي الصفوف العليا على مقاعد أكثر. وبشكل مماثل، تحتوي مستويات الطاقة الأبعد عن النواة على مستويات ثانوية أكثر للطاقة. 84 4 مستويات ثانوية 4 = n 3 مستويات ثانوية 3 = n مستويان ثانويان 2 = n مستوى ثانوي واحد 1 = n وزارة التعليم Ministry of Education 2024-1446

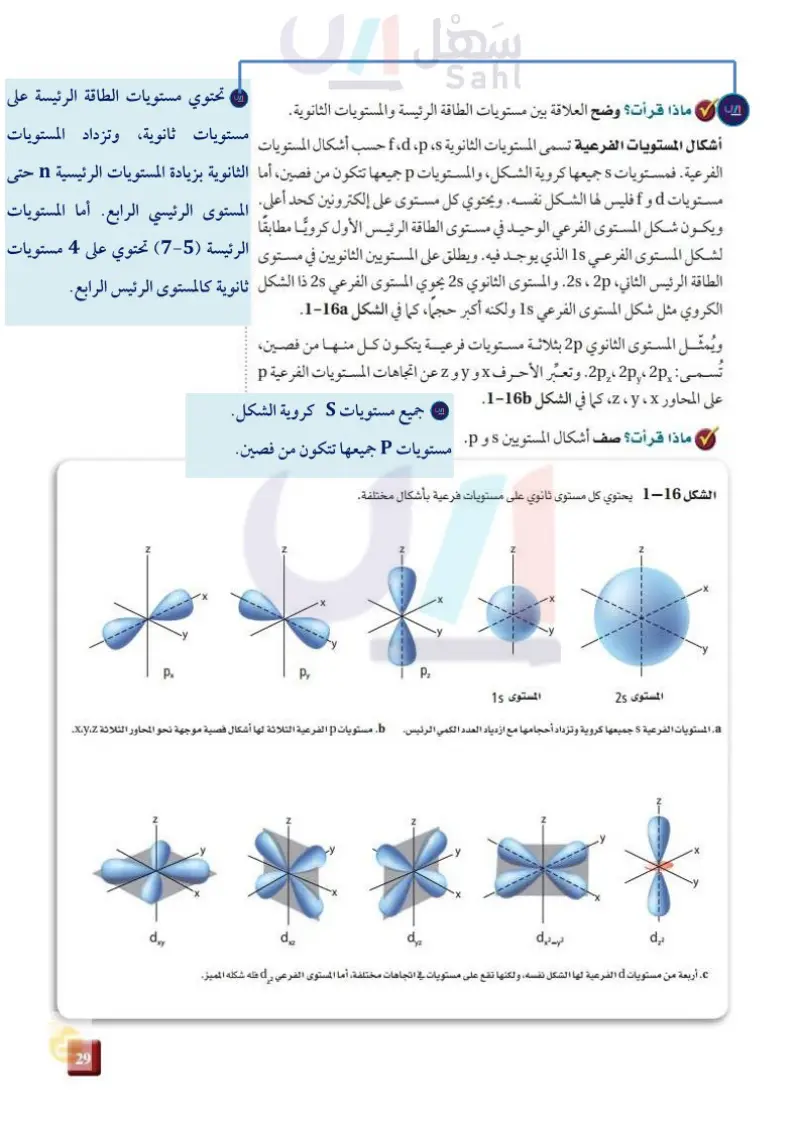
N X ماذا قرأت ؟ وضح العلاقة بين مستويات الطاقة الرئيسة والمستويات الثانوية. أشكال المستويات الفرعية تسمى المستويات الثانوية ، ، ، ، ،f ، d حسب أشكال المستويات الفرعية. فمستويات جميعها كروية الشكل، والمستويات p جميعها تتكون من فصين، أما مستويات d و f فليس لها الشكل نفسه. ويحتوي كل مستوى على إلكترونين كحد أعلى. ويكون شكل المستوى الفرعي الوحيد في مستوى الطاقة الرئيس الأول كرويًا مطابقًا لشكل المستوى الفرعي 1 الذي يوجد فيه. ويطلق على المستويين الثانويين في مستوى الطاقة الرئيس الثاني، 2s ، 2p . والمستوى الثانوي 28 يحوي المستوى الفرعي 2s ذا الشكل الكروي مثل شكل المستوى الفرعي 15 ولكنه أكبر حجما، كما في الشكل 2-16a. ويُمثل المستوى الثانوي 2p بثلاثة مستويات فرعية يتكون كل منها من فصين، : 2px ،2 ، 2. وتعبّر الأحرف x و y و 2 عن اتجاهات المستويات الفرعية p تسم Z على المحاور x ، ، ، كما في الشكل 16-2. ماذا قرأت ؟ صف أشكال المستويين s و p . الشكل 16-2 يحتوي كل مستوى ثانوي على مستويات فرعية بأشكال مختلفة. Z Z Z px Py Pz -x N X المستوى 25 المستوى 15 a المستويات الفرعية S جميعها كروية وتزداد أحجامها مع ازدياد العدد الكمي الرئيس. b. مستويات p الفرعية الثلاثة لها أشكال فصية موجهة نحو المحاور الثلاثة xyz. 85 وارفت عليم Ministry of Education 2024-1446 Z dxy Χ Z dxz Z dyz -y Z dx2-y2 X N- d,2 X c أربعة من مستويات d الفرعية لها الشكل نفسه، ولكنها تقع على مستويات في اتجاهات مختلفة، أما المستوى الفرعي ل فله شكله المميز. 2 2 1

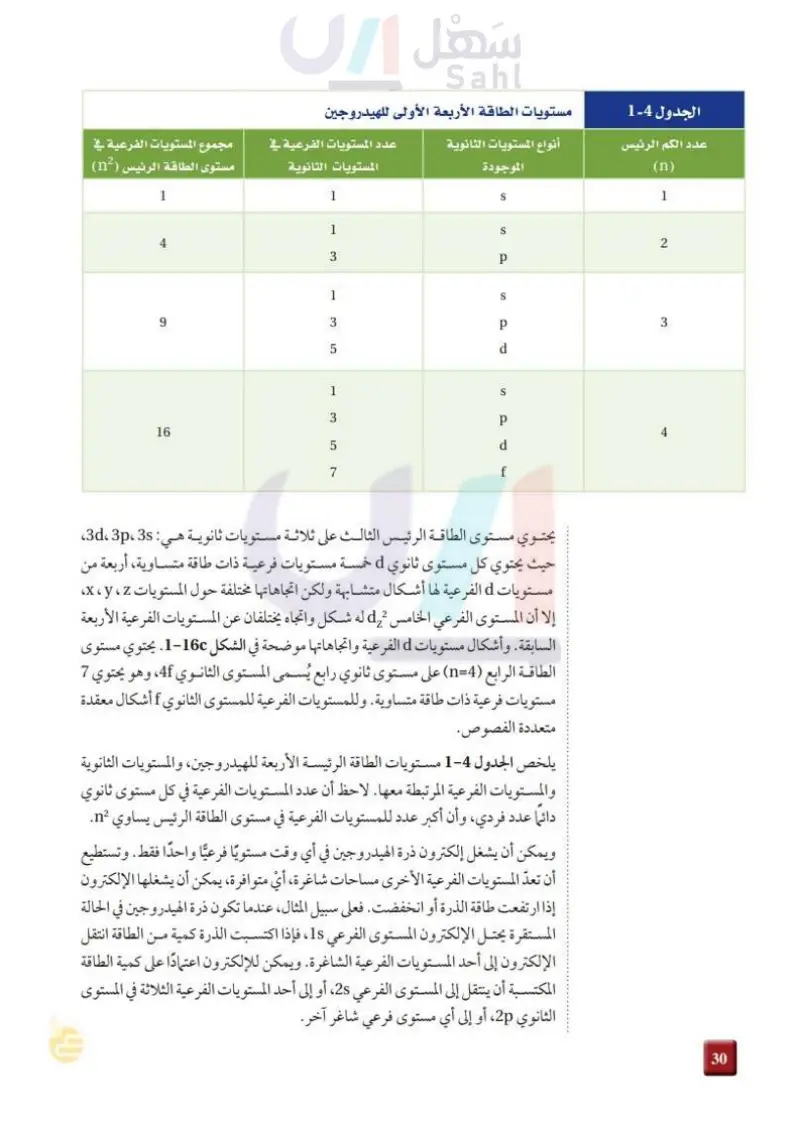
1 الجدول 4-2 عدد الكم الرئيس (n) مستويات الطاقة الأربعة الأولى للهيدروجين أنواع المستويات الثانوية الموجودة عدد المستويات الفرعية في المستويات الثانوية مجموع المستويات الفرعية في مستوى الطاقة الرئيس (n2) 1 4 6 1 1 S S 3 p 1 3 LO 5 S p d 1 S 3 16 5 له 7 p d f 2 3 4 يحتوي مستوى الطاقة الرئيس الثالث على ثلاثة مستويات ثانوية هي: 3d p، 3s حيث يحتوي كل مستوى ثانوي d خمسة مستويات فرعية ذات طاقة متساوية، أربعة من مستويات d الفرعية لها أشكال متشابهة ولكن اتجاهاتها مختلفة حول المستويات x ، y ، z، إلا أن المستوى الفرعي الخامس له شكل واتجاه يختلفان عن المستويات الفرعية الأربعة السابقة. وأشكال مستويات d الفرعية واتجاهاتها موضحة في الشكل 2-16c. يحتوي مستوى الطاقة الرابع (4=n) على مستوى ثانوي رابع يُسمى المستوى الثانوي 4f، وهو يحتوي 7 مستويات فرعية ذات طاقة متساوية . وللمستويات الفرعية للمستوى الثانوي f أشكال معقدة متعددة الفصوص. يلخص الجدول 4-2- مستويات الطاقة الرئيسة الأربعة للهيدروجين، والمستويات الثانوية والمستويات الفرعية المرتبطة معها . لاحظ أن عدد المستويات الفرعية في كل مستوى ثانوي دائما عدد فردي، وأن أكبر عدد للمستويات الفرعية في مستوى الطاقة الرئيس يساوي n2. ويمكن أن يشغل إلكترون ذرة الهيدروجين في أي وقت مستويًا فرعيًا واحدًا فقط. وتستطيع أن تعدّ المستويات الفرعية الأخرى مساحات شاغرة ، أي متوافرة، يمكن أن يشغلها الإلكترون إذا ارتفعت طاقة الذرة أو انخفضت فعلى سبيل المثال، عندما تكون ذرة الهيدروجين في الحالة المستقرة يحتل الإلكترون المستوى الفرعي ،15 ، فإذا اكتسبت الذرة كمية من 1s الطاقة انتقل الإلكترون إلى أحد المستويات الفرعية الشاغرة. ويمكن للإلكترون اعتمادًا على كمية الطاقة المكتسبة أن ينتقل إلى المستوى الفرعي 2s، أو إلى أحد المستويات الفرعية الثلاثة في المستوى الثانوي 2p، أو إلى أي مستوى فرعي شاغر آخر. وزارة التعليم Ministry of Education 2024-1446 86

التقويم 2-2 الخلاصة يربط نموذج بور للذرة طيف 15. الفكرة الرئيسة فسّر لماذا يحتوي طيف الانبعاث الذري على ترددات معينة للضوء، حسب نموذج بور الذري؟ انبعاث الهيدروجين بانتقال 16. عدد المستويات الثانوية الموجودة في مستويات الطاقة الرئيسة الأربعة لذرة إلكترون من مستويات طاقة و الهيدروجين. عليا إلى مستويات طاقة منخفضة. 17. حدّد المستويات الفرعية في كل مستوى ثانوي ، وفي كل مستوى ثانوي p تربط معادلة دي برولي طول لمستويات الطاقة الرئيسة الأربعة لذرة الهيدروجين. موجة الجسيم مع كتلته وسرعتها 18. فسر لماذا يكون موقع الإلكترون في ذرة غير معلوم بدقة. مستخدمًا مبدأ هايزنبرج للشك والطبيعة الموجية - الجسيمية؟ وكيف يُعرف موقع وثابت بلانك. يفترض النموذج الميكانيكي الإلكترونات في الذرات؟ الكمي للذرة أن للإلكترونات 19. احسب مستعينًا بالمعلومات في الجدول 21، كم مرة يساوي نصفُ قطر مدار ذرة الهيدروجين السابع بالنسبة إلى نصف قطر مدارها الأول، حسب خواص الموجات. تشغل الإلكترونات مناطق نظرية بور؟ ثلاثية الأبعاد في الفراغ تُسمى 20 قارن بين نموذج بور والنموذج الميكانيكي الكمي للذرة. المستويات الفرعية. 87 وااقف عليم Ministry of Education 2024-1446

احسب مستعينا بالمعلومات في الجدول 1-1 ، كم مرة يساوي نصف قطر مدار ذرة الهيدروجين السابع بالنسبة إلى نصف قطر مدارها الأول ، حسب نظرية بور ؟

فسر لماذا يكون موقع الإلكترون في ذرة غير معلوم بدقة . مستخدما مبدأ هايزنبرج للشـك والطبيعـة الموجية - الجسيمية ؟ وكيـف يعرف موقع الإلكترونات في الذرات ؟





 0
0