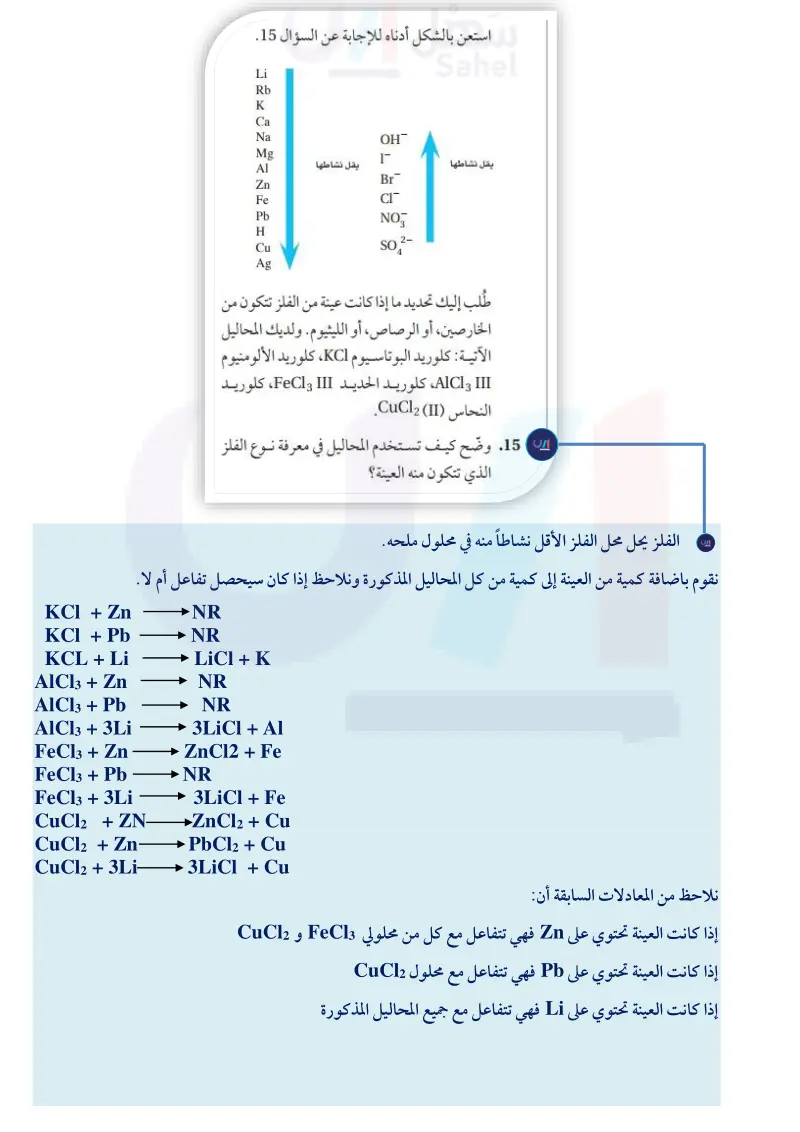
صيغ الأملاح المائية - الكيمياء2-1 - ثاني ثانوي
الفصل1: الحسابات الكيميائية
الفصل3: الجدول الدوري والتدرج في خواص العناصر
الفصل4: المركبات الأيونية والفلزات
22 22 1-2 الأهداف صيغ الأملاح المائية توضح المقصود بالملح Formulas of Hydrates المائي وتربط اسمه بتركيبه. رابط الدرس www.ien.edu.sa تحدد صيغة ملح مائي من البيانات المختبرية. مراجعة المفردات الشبكة البلورية: الترتيب الفكرة الرئيسة الأملاح المائية مركبات أيونية صلبة فيها جزيئات ماء محتجزة. الربط مع الحياة تُعبأ بعض المنتجات - ومنها المعدات الإلكترونية- في صناديق مع أكياس صغيرة مكتوب عليها "مجفف". وتضبط هذه الأكياس الرطوبة بامتصاص الماء. ويحتوي بعضها على مركبات أيونية تسمى الأملاح المائية. الهندسي الثلاثي الأبعاد تسمية الأملاح المائية Naming Hydrates للجسيمات. المفردات الجديدة الملح المائي هل راقبت يوما بلورات تتكون ببطء من محلول مائي؟ تلتصق جزيئات الماء أحيانًا بالأيونات خلال تكون المادة الصلبة. وتسمى جزيئات الماء التي تصبح جزءًا من البلورة ماء التبلور. وتُسمى المواد الأيونية الصلبة التي تُحتجز فيها جزيئات ماء أملاحًا مائية. فالملح المائي مركب يحتوي على عدد معين من جزيئات الماء المرتبطة بذراته. ويبين الشكل 5- الحجر الكريم الجميل المعروف بالأوبال ، وهو ثاني أكسيد السليكون المائي (2 SiO) الذي يحتوي على ماء والألوان الفريدة ناتجة عن وجود الماء في المعدن. يكتب في صيغة الملح المائي عدد جزيئات الماء المرتبطة بوحدة الصيغة للمركب تاليا لنقطة، مثل CoCl2 .6H2O. ويُسمى هذا المركب كلوريد الكوبلت (II) سداسي الماء (أي يحتوي على 6 جزيئات ماء). وتدخل كتلة جزيئات الماء المرتبطة بوحدة الصيغة حساب الكتلة المولية. ويختلف عدد جزيئات ماء التبلور من ملح إلى آخر، ويبين الجدول 1-1 بعض الأملاح المائية الشائعة. الشكل 15 إن وجود الماء وشوائب المعادن المختلفة يفسران التنوع الكبير لأحجار الأوبال الجدول 1-1 صيغ الأملاح المائية الكريمة. وتحدث تغيرات أخرى في اللون عندما يجف. المقطع | عدد جزيئات الماء الصيغة الاسم أحادي ثنائي ثلاثي رباعي 1 CaCl2 . 2 20 2 3 4 2204.20 (4) إكسالات الأمونيوم أحادية الماء. خماسي سداسي سباعي ثماني عشاري 5678 2° FePO4. 4H2O CuSO4.5H2O كلوريد الكالسيوم ثنائي الماء. 320 20 30 Na2H أسيتات الصوديوم ثلاثية الماء 10 CoCl2.6H2O MgSO4.7H2O Ba (OH) 2. 8H20 Na2CO3.10H2O فوسفات الحديد (III) رباعية الماء. كبريتات النحاس (II) خماسية الماء الماء. كلوريد الكوبلت (II) سداسي كبريتات الماغنسيوم سباعية الماء. هيدروكسيد الباريوم ثماني الماء. كربونات الصوديوم عشارية الماء وزارة التعليم Ministry of Education 2024-1446

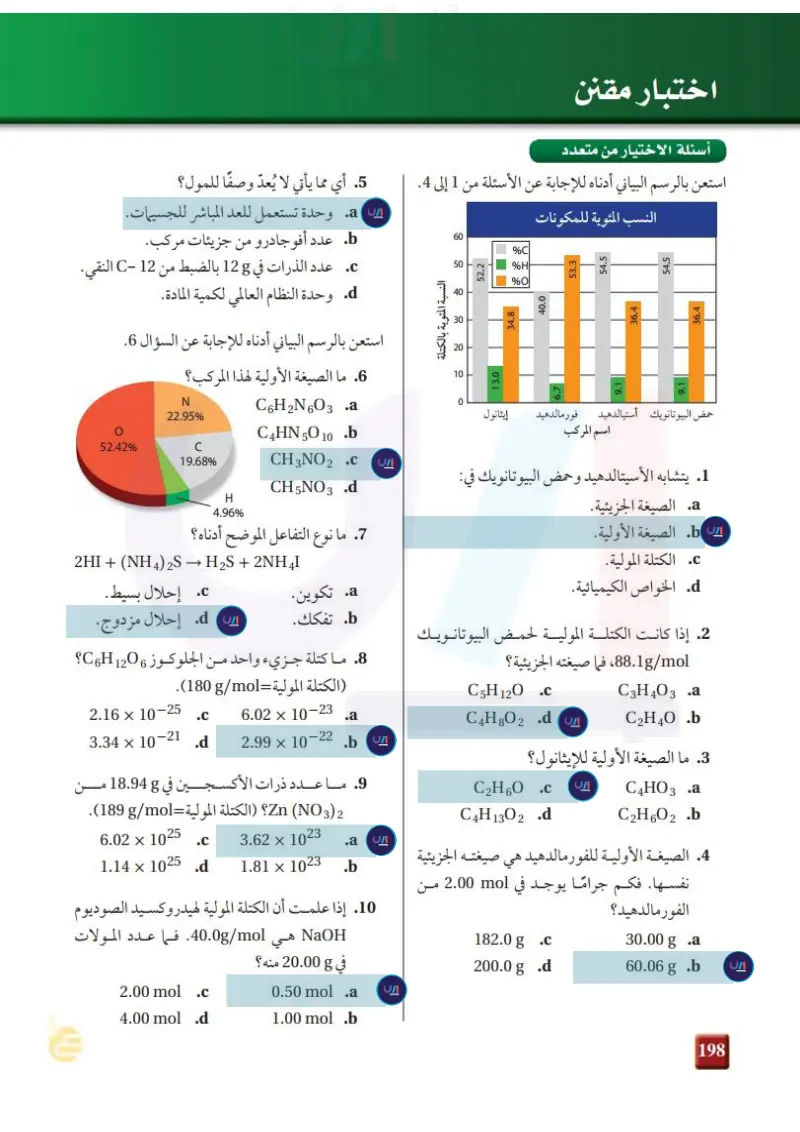
إن وجود الماء وشوائب المعادن المختلفة يفسران التنــوع الكبيــر لأحجــار الأوبــال الكريمة. وتحــدث تغيرات أخرى في اللون عندما يجف.
C b a كلوريد الكوبلت (II) سداسي الماء الزهري يمكن تسخين الملح المائي لطرد ماء التبلور كلوريد الكوبلت (II) اللامائي أزرق الشكل 6 - 1 يمكن إزالة ماء التبلور بتسخين الملح المائي، لتكوين ملح لا مائي قد يبدو مختلفًا جدا عن الملح المائي. تحليل الأملاح المائية Analyzing a Hydrates عند تسخين ملح مائي، تُطرد جزيئات الماء تاركة وراءها الملح اللامائي. انظر الشكل 6-1؛ حيث توضح سلسلة الصور أنه عند تسخين كلوريد الكوبلت (II) السداسي الماء الزهري اللون، ينتج كلوريد الكوبلت (II) اللامائي الأزرق اللون. كيف يمكنك تحديد صيغة ملح مائي ؟ يجب أن تحسب عدد مولات الماء المرتبطة بمول واحد من الملح المائي. افترض أن لديك عينة مكونة من 5.00g من كلوريد الباريوم المائي. ولأنك تعرف أن صيغة الملح هي BaCl2 xH20، فإنه يجب أن تحدد قيمة x، وهي معامل H2O في صيغة الملح المائي، والتي تشير إلى عدد مولات جزيئات الماء المرتبطة بمول واحد من BaCl2. وحتى تجد قيمة ، يجب أن تسخن العينة للتخلص من ماء التبلور. وافترض أنك بعد تسخينها وجدت أن كتلة الملح اللامائي BaCl2 هي 8 4.26. g إذن كتلة ماء التبلور تساوي الفرق بين كتلة الملح المائي (5.00) وكتلة الملح اللامائي (4.268) . 5.00 g -4.26 g = 0.74 g H2O وبعد أن عرفت كتلة كل من BaCl2 و H2O في العينة ، يمكنك تحويل هذه الكتل إلى مولات باستعمال الكتل المولية. الكتلة المولية لـ BaCl هي 208.23g/mol، وللماء18.02g/mol. 2 23 Ministry of Education 2024-1446 4.26 g BaCl2 x 1 mol BaCl2 208.23 g BaCl2 = 0.0205 mol BaCl2 0.74 g H₂Ox X = mol H2O mol BaClz = 1 mol H20 18.02 g H2O 0.041 mol H2O 0.0205 mol BaCl2 = 0.041 mol H2O = 2.0 mol H2O 1.00 mol BaCl 2 = 21 إذن نسبة مولات H20 إلى مولات BaCl هي 2 إلى ،1، لذا فإن mol H2O 2 ترتبط بـ mol BaCl2 1. أي أنّ قيمة المعامل x هي ،2 وصيغة الملح المائي هي 220 BaCl2. ما اسم هذا الملح؟ ماذا قرأت؟ فسّر لماذا تستعمل النقطة في صيغة الملح المائي ؟

24 24 مثال 5-1 تحديد صيغة الملح المائي وضعت عينة من كبريتات النحاس المائية الزرقاء 20 CuSO4.x كتلتها g 2.50 في جَفنة وسُخنت. وبقي بعد التسخين g 1.59 من كبريتات النحاس اللامائية البيضاء CuSO4 . ما صيغة الملح المائي؟ وما اسمه؟ 1 تحليل المسألة لقد أعطيت كتلة كبريتات النحاس المائية ، وكبريتات النحاس اللامائية . كما أنك تعرف صيغة المركب ما عدا قيمة x، وهي معامل H2O في صيغة الملح المائي، والتي تشير إلى عدد مولات ماء التبلور. المعطيات كتلة الملح المائي 2 g = CuSO4. x 2.50 كتلة الملح اللامائي g = CuSO4 1.59 الكتلة المولية لـ g/mol = H2O 18.02 الكتلة المولية لـ 4 g/mol = CuSO 159.6 2 حساب المطلوب حدد كتلة الماء المفقود كتلة الماء المفقود = كتلة الملح المائي – كتلة الملح اللامائي اطرح كتلة الملح اللامائي CuSO4 من كتلة الملح المائي CuSO4 .XH2O المطلوب صيغة الملح المائي = ؟ اسم الملح المائي= ؟ 2.50g - 1.59 g = 0.91 g حول الكتلة المعلومة للماء والملح المائي إلى مولات مستعملاً معامل التحويل الذي يربط المولات بالكتلة – مقلوب الكتلة المولية. احسب عدد مولات CuSO4 بالتعويض بقيمة كتلة CuSO4 مضروبا في مقلوب الكتلة المولية. احسب عدد مولات ، بالتعويض بقيمة كتلة 2 مضروبا في مقلوب الكتلة المولية. 1.59 g CuSO4 × 0.91 g H20 x 1 mol CuSO4 159.6 g CuSO4 1 mol H₂O 18.02 g H₂O = 0.00996 mol CuSO 4 = 0.05 mol H2O mol H2O mol CuSO4 0.050 mol H2O x = احسب أبسط نسبة عددية بالتعويض بعدد مولات H2O ، وعدد مولات CuSO4. 5 5 mol H2O 1 mol CuSO4 = X = 0.00996 mol CuSO4 إذن، فصيغة الملح المائي هي CuSO4 5H20، واسمه كبريتات النحاس (II) الخماسية الماء. 8 تقويم الإجابة كبريتات النحاس (II) الخماسية الماء، ملح شائع، ومدون في الجدول 1- 1. وزارة التعليم Ministry of Education 2024-1446

مسائل تدريبية 21. يظهر في الشكل المجاور تركيب أحد الأملاح المائية. فما صيغة هذا الملح المائي؟ وما اسمه؟ 22. تحفيز سخنت عينة كتلتها 8 11.75 من ملح مائي شائع لكلوريد الكوبلت II. وبقي بعد التسخين mol 0.0712 من كلوريد الكوبلت اللامائي. ما صيغة هذا الملح المائي ؟ وما اسمه؟ استعمالات الأملاح المائية Uses of Hydrates للأملاح المائية استعمالات مهمة في مختبر الكيمياء. فكلوريد الكالسيوم يكوّن ثلاثة أملاح مائية : أحادي الماء، وثنائي الماء، وسداسي الماء. ويوضع كلوريد الكالسيوم اللامائي في قعر أوعية محكمة الإغلاق تُسمى المجففات، كما في الشكل 7-1؛ حيث يقوم بامتصاص الرطوبة من الهواء في داخل المجفف، ويصنع جوا جافًا مناسبًا لحفظ المواد. وتضاف كبريتات الكالسيوم أحيانًا إلى المذيبات العضوية كالإيثانول والإيثيل إيثر للحفاظ عليها خالية من الماء. H₂O 51.2% MgSO4 48.8% إن قدرة الملح اللامائي على امتصاص الماء له أيضًا بعض التطبيقات التجارية. فالمعدات الإلكترونية والبصرية، وبخاصة تلك التي تشحن عبر البحار، غالبًا ما تُعبأ مع أكياس الشكل 7-1 يجفف كلوريد الكالسيوم من المُجفّفات التي تمنع تأثير الرطوبة في الدوائر الإلكترونية الدقيقة. وتستعمل بعض الهواء من جزيئات الماء. كما يستعمل الأملاح المائية مثل كبريتات الصوديوم المائية 4.1 Na 2SO) لخزن الطاقة في المختبر في حفظ المواد الكيميائية من رطوبة الجو. الشمسية. فعندما تُسخّن الشمس الملح المائي إلى أكثر من 32°C تذوب 4 Na 2SO في مولات ماء التبلور العشرة، وخلال ذلك يمتص الملح المائي الطاقة، وهذه الطاقة تنطلق عندما تنخفض درجة الحرارة ويتبلور الملح المائي ثانية. التقويم 2-1 الخلاصة تتكون صيغة الملح المائي من صيغة • . 23. الفكرة الرئيسة وضح تركيب الملح المائي. 24. سمّ المركب الذي صيغته SrCl2.6H2O المركب الأيوني وعدد جزيئات ماء : 25. صف الخطوات العملية لتحديد صيغة الملح المائي معللا كل خطوة. التبلور المرتبطة بوحدة الصيغة. .26 طبق يحتوي ملح مائي على mol 0.050 من الماء لكل mol 0.00998 من المركب الأيوني. اكتب صيغة عامة للملح المائي. يتكون اسم الملح المائي من اسم المركب متبوعا بمقطع يدل على عدد جزيئات الماء المرتبطة بمول 28. رتب الأملاح المائية الآتية تصاعديا بحسب تزايد النسبة المئوية للماء 27. احسب كتلة ماء التبلور إذا فقد ملح مائي mol 0.025 من الماء عند تسخينه. واحد من المركب. يتكون الملح اللامائي عند تسخين الملح المائي. MgSO 4.7H2O Ba (OH) 2.8H2O CoCl2.6H 20:4 29. طبق فسّر كيف يمكن استعمال الملح المائي في الشكل 17 بوصفه طريقة تقريبية لتحديد احتمال سقوط المطر؟ 25 Ministry of Education 2024-1446

رتب الأملاح المائية الآتية تصاعديا بحسب تزايد النسبة المئوية للماء فيها:MgSO4.7H2O،Ba(OH)2.8H2O،CoCl2.6H2O


ســخنت عينة كتلتها 11.75g من ملح مائي شــائع لكلوريد الكوبلت II .وبقي بعد التسخين 0.0712mol من كلوريد الكوبلت اللامائي ما صيغة هذا الملح المائي؟ وما اسمه؟

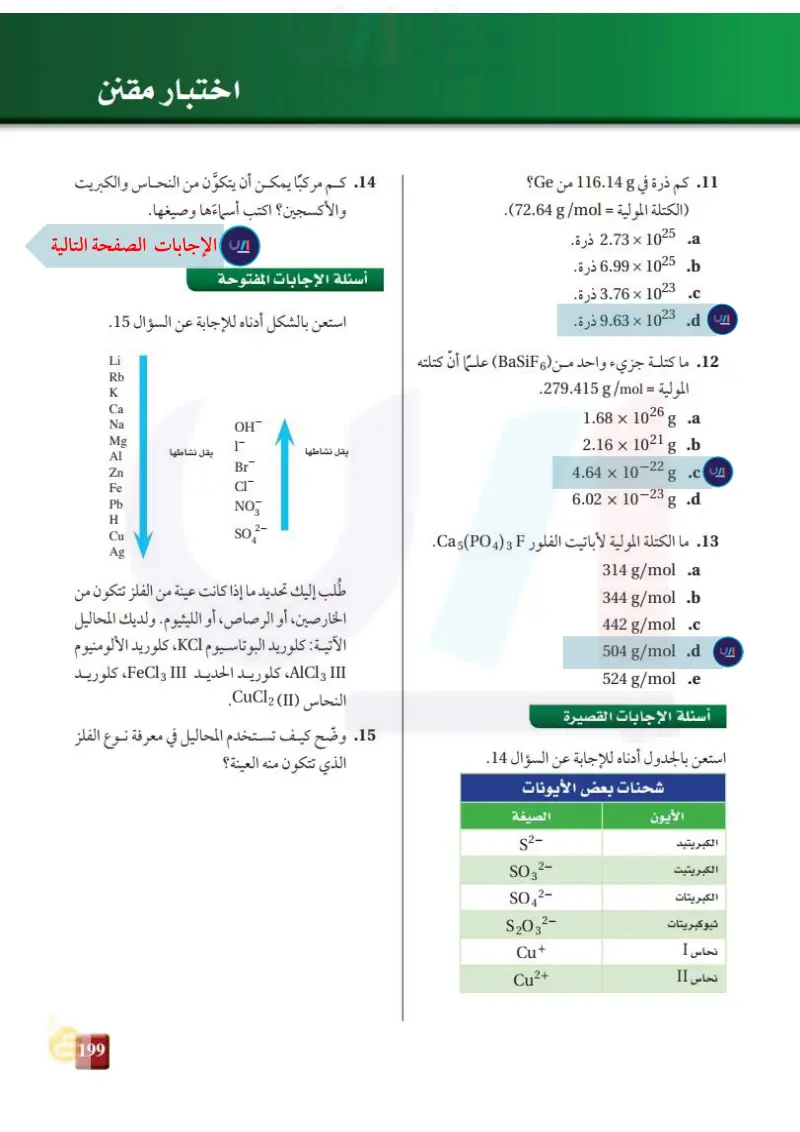
يجفف كلوريد الكالسيوم الهواء من جزيئات الماء



 0
0 

 0
0 

 0
0 

 0
0