نماذج الذرة - العلوم 2 - ثالث متوسط
كيف تستخدم كتاب العلوم؟
الفصل5: تركيب الذرة
الفصل6: الجدول الدوري
الفصل7: البناء الذري والروابط الكيميائية
الفصل8: التفاعلات الكيميائية
مصادر تعليمية للطالب
الوحدة كيمياء المادة ما العلاقة بين الجدول الدوري وتكنولوجيا المعلومات والاتصالات؟ ۱۲

Carbon Nitra N 811 12.011 14.007 minum Silicon Phosphorus 13 14 15 Al Si P 982 28 010 30.9974 Germanium 32 Arsenic مشاريع في عام 1869م توقع العالم مندليف وجود عنصر في الجدول الدوري يقع بين عنصري السليكون والقصدير سماء ekasilicon، وقدر أن كتلته الذرية تساوي 72 تقريبا. وفي عام 1886 م اكتشف العالم الألماني كليمنز وينكلر هذا العنصر وسماء جرمانيوم نسبة الى بلده ألمانيا. وحدد كتلته الذرية بـ 72,6. وهو عنصر شبه فلزي، يدخل في صناعة الإلكترونيات ومنها أجهزة الاتصالات اللاسلكية، حيث يستخدم في الدوائر الالكترونية والترانزستور والثنائيات ( الديود)، وفي الوقت الحاضر يستخدم بشكل كبير في صناعة الألياف البصرية المستخدمة في شبكات الاتصالات والانترنت الوحدة رجع إلى الموقع الإلكتروني أو أي مواقع اخرى للبحث عن دکتره از او اسرع مشروع سكن ان تمام است. من المتاريخ المقدم حالات م المهن اكتب بحثا عن طبيعة قبل قير الأشعة وكيف يقضون يومهم واحتياطات السلامة التي يطبقوها العقبة ابحث حول أحد العناصر التي تدخل في صناعة الإلكترونيات واكسب تقريرا من أمها، وكيفية استخدامها. م القصلاح حم ترزحا للجدول الدورى مكونا من علب صغيرة فارغة، على أن تضع واجلها بطاقات معلومات عن كل عنصر المسافر السلعة استكشف كيف الخدم فلاتر المناصر المشعة في جواب الحياة المختلفة

في عام 1869م توقع العالم مندليف وجود عنصر في الجدول الدوري يقع بين عنصري السليكون والقصدير
الفصل الفكرة العامة كلما توافر لدينا معلومات جديدة استطعنا تقديم نموذج للذرة أكثر تفصيلاً ودقة . الدرس الأول نماذج الذرة الفكرة الرئيسة تحتوي الدرات على بروتونات و نيوترونات في نواة كثيفة وصغيرة جدا، والكترونات تدور في منطقة واسعة حول النواة الدرس الثاني النواة الفكرة الرئيسة النواة هي مركز الذرة. ويكون عدد البروتونات في قواة عنصر ما ثابتا، أما عدد النيوترونات فقد يختلف. تركيب الذرة ١٤ يا له من منظر جميل هذه صورة لذرة نحاس محاطة بثمان وأربعين درة حديد. ما الخبرات" وكيف اكتشفت؟ ستتعرف في هذا الفصل بعض العلماء، واكتشافاتهم الرائعة حول طبيعة الدرة. دفتر العليم صف الذرة، في ضوء ما تعرفه عنها وزارة التعليم 2078-1445

صورة لذرة نحاس محاطة بثمان وأربعين ذرة حديد ما الذرات؟
الفكرة العامة لفصل تركيب الذرة
الفكرة الرئيسة نماذج الذرة
الفكرة الرئيسة النواة
نموذج لشيء لا يرى نشاطات تمهيدية هل سبق أن حصلت على هدية مغلفة، وكنت تتلهف لفتحها ؟ ماذا فعلت لتعرف ما بداخلها؟ إن الذرة تشبه - إلى حد بعيد - تلك الهدية المغلفة فأنت تريد استكشافها، ولكنك لا تستطيع رؤيتها مباشرة أو بسهولة سيعطيك معلمك قطعة من الصلصال وبعض القطع المعدنية عد القطع المعدنية " اغرس القطع المعدنية في قطعة الصلصال حتى تخفيها. بدل قطعتك الصلصالية بقطعة أحد زملائك. تحسّس الصلصال يعود (تنظيف أسنان) خشبي رفيع لكي تكتشف عدد القطع المعدنية التي بداخله وأشكالها ه التفكير الناقد ارسم في دفتر العلوم أشكال القطع المعدنية كما تعرفتها. ودون عددها، ثم قارن بين الرسم وبين عدد القطع المعدنية الموجودة فعلا في الصلصال. المطويات أجزاء الذرة اعمل المطوية التالية منظمات الأفكار التباعدك على تنظيم أفكارك و مراجعة مكونات الذرة. الخطوة ١. قطعتين من الورق إحداهما فوق الأخرى وعلى مسافة سم من حافة الورقة الأولى.. الخطوة اطو الأطراف السفلية للاوراق على أن يصبح لديك أربع أشرطة. الخطوة 3 عنون الأشرطة بـ: ذرة الكترون، بروتون نيوترون، كما في الشكل المقابل. تره 14TE اقرأ واكتب في أثناء قراءتك هذا الفصل ؛ صف كيف تم اكتشاف كل مكون من مكونات الذرة، ودون الحقائق في أماكنها المناسبة في المطوبة. وزارة التعليم

ارسم في دفتر العلوم أشكال القطع المعدنية كما تعرفتها ودون عددها ثم قارن بين الرسم وبين عدد القطع المعدنية الموجودة فعلا في الصلصال
صف كيف تم اكتشاف كل مكون من مكونات الذرة ودون الحقائق في أماكنها المناسبة في المطوية
17 أتهيأ للقراءة تصورات ذهنية اتعلم كون في أثناء قراءتك للنص تصورات ذهبية، وذلك بتخيل كيف تبدو لك أوصاف النص: صوت أم شعير، أم رائحة، أم طعم وابحث عن أي صور أو أشكال في الصفحة تساعدك على السريد من الفهم. أتدرب اقرأ الفقرة الآتية، وركز على الأفكار البارزة في أثناء قراءتك التشكل لها صورة ذهنية في مخيلتك. فالذرة في النموذج النووي نواة صغيرة جدا تحوي البروتونات الموجبة الشحنة والنيوترونات المتعادلة الشحنة، أما الإلكترونات سالبة الشحنة، فتشغل الحيز المحيط بالنواة. وفي الذرة المتعادلة يتساوى عدد الإلكترونات مع عدد البروتونات. صفحة ٢٤ . حاول أن تتصور الدرة معتمدا على الوصف السابى، ثم انظر بعد ذلك إلى الشكل ١٣ صفحة ٢٥ في الكتاب ما حجم المراة كم وتونا في الذرة ؟ ما نوع شحة كل من البروتون والإلكترون؟ أطبق دوّن من خلال قراءتك لهذا الفصل ثلاثة مواضيع يمكنك تصورها، ثم ارسم مخططا بسيطا يوضح ما تخيلته. دارة التعليم

تصورات ذهنية: تركيب الذرة
إرشاد يساعدك التصور الذهبي على تذكر ما تقرأ توجيه القراءة وتركيزها ركز على الأفكار الرئيسة عند قراءتك الفصل باتباعك ما يأتي: قبل قراءة الفصل أجب عن العبارات الواردة في ورقة العمل أدناه. اكتب (م) إذا كنت موافقا على العبارة. . اكتب (غ) إذا كنت غير موافق على العبارة. بعد قراءة الفصل ارجع إلى هذه الصفحة لترى إن كنت قد غيرت رأيك حول أي من هذه العبارات. إذا غيرت إحدى الإجابات فبين السبب. صحح العبارات غير الصحيحة. استر شيد بالعبارات الصحيحة في أثناء دراستك. قبل القراءة م الوغ العبارة ۲ درس التلائمة القلماء الذرة من خلال إجراء التجارب بين العالم كروكس أن الشعاع الذي شاهده ما هو إلا ضوء؛ لأنه كان ينحني بفعل قوة المغناطيس توقع العالم ودر فورد أن ترتد جميع جسيمات ألما عند اصطدامها بصفيحة الذهب. تتكون الذرة في معظمها من فراغ. ليس النيوترومات الشحنة كهربائية. تتحرك الإلكترونات في مسارات محددة تماما حول النواة. درات العنصر الواحد لها العدد تقه من البروتونات والنيوترونات . يمكن أن تتحول ذرات عنصر معين إلى ذرات عنصر آخر بفعل التحلل الإشعاعي النظائر المشعة خطيرة جدا وغير معيدة للإنسان. بعد القراءة منوع درارك التصليح

الدرس نماذج الذرة رابط الفرس الوقفي www.ley.l في هذا الدرس الأهداف الآراء القديمة حول بنية الذرة بدأ الناس يتساءلون عن ماهية المادة منذ ٢٥٠٠ سنة تقريبا، حيث اعتقد بعض توضح كيفية اكتشاف العلماء الفلاسفة القدماء أن المادة تتكون من جسيمات صغيرة جدا. وقد عللوا ذلك بأنك إذا أخذت قطعة من مادة ما، ثم قسمتها إلى نصفين، وقسمت كل نصف منها الحالي للمدرة. تصف تركيب نواة الذرة. للجسيمات المكونة للذرة. توضح مراحل تطور النموذج إلى قسمين أيضا، واستمررت في التقسيم فإنك في النهاية ستجد نفسك غير قادر على الاستمرار؛ لأنك ستصل في النهاية إلى جسيم غير قابل للتقسيم، ولذلك أطلقوا على هذه الجم یمات اسم الذرات atoms. وهو مصطلح معناه غير قابل توضح أن جميع المواد تتكون من للتقسيم، ولكي تتخيل ذلك بطريقة أخرى تصوّر أن لديك سلسلة من الخرز كما في الشكل ١. وأنك قسمتها إلى قطع أصغر فأصغر، ففي النهاية ستصل إلى خرزة واحدة. وقد أشار الله تعالى إلى ماهو أصغر من الذرة في قوله : في وكال الذين كفروا لا تأتِينَا السَّاعَةُ قُل بَلَى وَرَني لَاننَّكُمْ عَالِمِ الْغَيْبِ لَا يَعْرُبُ عَنْهُ مِثْقَالُ ذرات الأهمية كل شيء في عالمنا مكون من ذرات. ذرة في السموات ولا في الأَرْضِ وَلا أَصْغَر من ذلِكَ وَلَا أَكثرُ إِلَّا فِي . مراصة المفردات شين سبا المادة: كل شيء له كتلة ويشغل لم يحاول قدماء الفلاسفة إثبات نظرياتهم بالتجارب العملية كما يفعل العلماء حيرا من الفراغ. المفردات الجديدة . العنصر . جسيمات ألفا . الأنود . البروتون الكاثود النيوترون اليوم ؛ فقد كانت نظرياتهم نتيجة للتفكير المجرد والجدل والمناقشات، دون أي دليل أو برهان أما العلماء اليوم فلا يقبلون نظرية غير مدعومة بالدليل التجريبي ولكن حتى لو أجرى الفلاسفة القدماء تجارب ليتمكنوا من اثبات وجود ذرات فلم يكن الناس في ذلك الوقت قد عرفوا كثيرًا معنى الكيمياء أو دراسة المادة ولم تكن الأجهزة اللازمة لدراسة المادة معروفة بعد، فظلت الدرات لغزا محيرا الإلكترون • السحابة الإلكترونية السنين طويلة، بل وحتى ما قبل ٥٠٠ سنة. الشكل ا يمكنك تقسيم شريط الخرز إلى قسمين، ثم تقسيم كل تصف إلى هكذا حتى تصل إلى خرزة ۱۸ واحدة، وهكذا يمكن تقسيم جميع المواة مثل شريط الحرز الى جسيم واحد اساسي يسمى (الذرة). درارة التعليم

النماذج الحديثة للذرة مضى وقت طويل قبل أن تتطور النظريات المتعلقة بالذرة. فقد بدأ العلماء في القرن الثامن عشر البحث لإثبات وجود الذرات في مختبر اتهم، رغم قلة إمكانات هذه المختبرات كما في الشكل .. ودرس الكيميائيون المادة وتغيراتها، فقاموا بإضافة مواد إلى بعضها البعض لإنتاج مواد أخرى، وقاموا بفصل مواد بعضها عن بعض ليتمكنوا من تعرف مكوناتها، فوجدوا أن هناك مواد معينة لا يمكن تجزئتها إلى مواد أبسط منها، أطلقوا عليها اسم العناصر. والعنصر Elennent مادة تتكون من نوع واحد من الذرات. فعنصر الحديد على سبيل المثال يتكون من ذرات الحديد فقط، وعنصر الفضة يتكون من ذرات الفضة فقط، وكذلك الأمر مع عنصر الكربون أو الذهب أو الأكسجين وغيرها. نظرية دالتون قام المدرس الإنجليزي الأصل جون دالتون في القرن التاسع عشر يدمج فكرة العناصر مع النظرية السابقة للدرة، واقترح مجموعة أفكار حول المادة، هي: تتكون المادة من ذرات. لا تنقسم الذرات إلى أجزاء أصغر منها. ذرات العنصر الواحد متشابهة تماما. تختلف ذرات العناصر المختلفة بعضها عن بعض. وقد صور دالتون الدرة على أنها كرة مصمتة متجانسة، أي أنها تشبه الكرة التي تظهر في الشكل .. الإثبات العلمي تم اختبار نظرية دالتون للذرة في النصف الثاني من القرن التاسع عشر. فهي عام ۱۸۷۰م، أجرى العالم الإنجليزي وليام كروكس William Crookes تجاربه باستخدام أنبوب الهواء تقريبا، وثبت بداخله قطعتين معدنيتين تسميان قطبين سيلهما ببطارية عن طريق أسلاك. الشكل على الرغم من أن إمكانات المختبرات قديما كانت بسيطة مقارنة بالمختبرات العلمية الحالية، إلا أن الكثير من الاكتشافات الملقلة حادثت خلال القرن الثامن عشر.. الذرات أصغر ما نظر ريم إلى الي على عدم عليه 回回 الشكل ٣ شوذح للذرة كما تصورها دالتون. درارة الكليم 14

الذرات أصغر مما تظن
نموذج للذرة كما تصورها دالتون
اكتشافات القرن الثامن عشر
الشكل استخــــدم كـروكــس اليونا زجاجيا يحوي كمية قليلة من الغاز، وعند توصيل طرفي الأنبوب بالبطارية انطلق في ما من القطب السالب (الكالود) إلى القطب المرجب (الأبود). وضح هل هذا الشيء الغريب قبوه أم سيل من الجسيمات ؟ الظل الأنود (المصعد) الأشعة المهبطية الكاثود جسم مثبت في ( المهبط ) مار الجسيمات تجربة كروكس القطبان قطعتان فالزيتان موصلتان للكهرباء، يُسمى أحدهما أنود (محمد) Anode وشحنته موجبة. أما الآخر فيسمى كالود (مهبط) Cathode. وشحته سالبة. وفي أنبوب كروكس كان المهبط عبارة عن قرص فلزي مثبت في أحد طرفي الأنبوب. وفي وسط الأنبوب قام كروكس بتثبيت جسم على هيئة (X) كما في الشكل . وعند توصيل الأنبوب بالبطارية توهج الأنبوب بشكل مفاجئ بوهج أخضر اللون، وظهر ظل الجسم الموجود في وسط الأنبوب على الطرف المقابل للمصعد, وقد فر كروكس ذلك بأن هناك شيئا يشبه الشعاع الضوني انتقل في خط مستقيم من المهبط إلى المصعد، مما المشكلة ما يقوم به عمال الطرق في أدى إلى تكون ظل للجسم الموجود في وسط الأنبوب، وهذا يحاكي ما يقوم هذه الصورة يحاكي ما حدث في ألبوب كروكس، والأشعة به عمال الطرق؛ حيث يستخدمون قوالب الاستنسل لحجب الطلاء عن بعض الأماكن على الطريق عند وضع علامات المرور الأرضية على الطرقات. انظر المهطية. الشكل .. الأشعة المهبطية ( أشعة الكاثود) افترض كروكس أن التوهج الأخضر الذي حدث داخل الأنبوب نتج عن أشعة أو سيل من الجسيمات الصغيرة، سميت بالأشعة المهيطلية (أشعة الكاثود)؛ لأنها تنتج عن المهبط، وقد سمي أنبوب كروكس بأنبوب الأشعة المهبطية (CRT) انظر الشكل ٦. وقد استخدم هذا الأنبوب منذ عدة سنوات في شاشات التلفاز والحاسوب. سانا فراح ما الأشعة المهبطية ؟ درارة للتعليم

محاكاة الأشعة المهبطية
اكتشاف الجسيمات المشحونة أثارت تجارب كروكس المجتمع العلمي في ذلك الوقت، ولكن كثيرًا منهم لم يقتنعوا أنّ الأشعة المهبطية عبارة عن تيار من الجسيمات. فهل كان هذا التوهج الأخضر ضوءاً أم جسيمات مشحونة ؟ حاول العالم الفيزيائي طومسون Thomson. عام ۱۸۹۷ م حل هذا التضارب عندما وضع مغناطيسا بالقرب من أنبوب كروكس عند تشغيله، كما في الشكل ٧ أدناه، فلاحظ انحناء الشعاع، ولأن المغناطيس لا يؤدي إلى انحناء الضوء فقد استنتج أن هذا الشعاع لا بد أن يكون جسيمات مشحونة تخرج من المهبط ( الكاثود ). الإلكترون أعاد طومون إجراء تجربة أنبوب أشعة الكاثود CRT مستخدمًا مهبطا من فلزات مختلفة، وكذلك غازات مختلفة في الأنبوب، فوجد أن الجسيمات المشحونة هي نفسها التي تنبعث مهما اختلفت الفلزات أو الغازات المستخدمة داخل الأنبوب، فاستنتج أن الأشعة المهبطية جسيمات سالبة الشحنة موجودة في كل المواد. ولكن كيف عرف طومون أن هذه الجسيمات تحمل الشحنة السالبة؟ من المعروف أن الشحنات المختلفة تتجاذب. وقد لاحظ طومسون أن هذه الجسيمات تنجذب نحو المصعد في الشحنة الموجبة، فأيقن عندها أن هذه الجسيمات لا بد أن تكون سالبة الشحنة، وسميت فيما بعد الإلكترونات Electrons لقد استنتج طومسون أيضًا أن هذه الإلكترونات مكون أساسي لجميع أنواع الذرات؛ لأنها تنتج عن أي مهبط مهما كانت ماذته. ولعل المفاجأة الكبرى الشكل 1 سمي أنبوب الأشعة المهبطية بهذا الاسم لأن الجسيمات تبدأ سيرها من المهبط (الكاثود) إلى المصعد (الأنود). وفي وقت من الأوقات استخدم هذا الأنبوب في شاشات التلفاز والحاسوب. التي جاء بها طومسون في تجاربه كانت الدليل على وجود جسيمات أصغر من الشكل ٧ عند وضع مغناطیس بالقرب من CRT تنحني الأشعة المهبطية. وبما أن الضوء لا يتأثر بالمغناطيس الذرة. نموذج طومسون للذرة تمت الإجابة عن بعض الأسئلة التي طرحها العلماء من خلال تجارب طومون ولكن هذه الإجابات أثارت أسئلة جديدة، منها: إذا كانت الذرات تحتوي على جيم واحد سالب الشحنة أو أكثر فستكون معظم الذرات سالبة الشحنة أيضًا، ولكن من الملاحظ أن المادة غير سالبة الشحنة، فهل تحتوي الذرات على شحنات موجبة أيضًا؟ إذا كان الأمر كذلك فإن الإلكترونات الالية والشحنات المجهولة الموجبة سيجعلان الذرة متعادلة الشحنة. وقد توصل طومسون إلى هذه النتيجة، وأضاف الشحنة الموجبة إلى نموذجه للذرة. وبناء على ذلك عدل طومسون نموذج دالتون المذرة، وصوّرها على أنها كرة من الشحنات الموجبة تتنتشر فيها إلكترونات سالبة الشحنة (بدلاً من الكرة المصمتة فقد استنتج طومون أن أشعة المهبط تتكون من جسيمات مشحونة درارة التعليم

سبب تسمية أنبوب الأشعة المهبطية بهذا الاسم
الصلبة)، كما هو موضح في نموذج كرة الصلصال في الشكل ٨؛ حيث إن عدد الشحنات الموجبة لكرة الصلصال يساوي عدد الشحنات السالبة للإلكترونات ولذلك فإن الدرة متعادلة. مانة ما الجسيمات المنتشرة في نموذج طومسون ؟ اكتشف مؤخرا أن ذرات العناصر لا تكون متعادلة دائما؛ لأن عدد الإلكترونات فيها قد يتغير، فإذا كان عدد الشحنات الموجبة أكثر من عدد الإلكترونات السالبة تكون الشحنة الكلية لذرة العنصر موجبة أما إذا كان عدد الإلكترونات السالبة الشكل نموذج كرة الصلصال التي الشحنة أكثر من عدد الشحنات الموجبة في درة العنصر فتكون شحنتها سالبة. تحوي كرات صغيرة منتشرة فيها، هو طريقة أخرى التصور تجربة رذرفورد الذرة حيث تحوي كرة الصلصال كل الشحنات لا يقبل العلماء أتي نموذج ما لم يتم اختباره، بحيث تدعم نتائج التجارب الموجبة والكرات الصغيرة والاختبارات المشاهدات السابقة. بدأ رذرفورد و مساعدوه عام ١٩٠٦م اختبار شكل الشحنات السالبة. صحة نموذج طومسون للذرة، فأرادوا لمعرفة ما يمكن أن يحدث عند إطلاق فر لماذا ضش طومسون الجيمات الموجة في نموذجه للذرة؟ جسيمات موجبة سريعة - كجسيمات ألفا Alpha particles - لتصطدم بمادة مثل صفيحة رقيقة من الذهب، وهذه الجسيمات الموجبة (جسيمات ألفا) تأتي من ذرات غير مستقرة ولأنها موجبة الشحنة فإنها ستنافر مع جسيمات المادة الموجبة. يبين الشكل ٩ كيف صممت التجربة، حيث يصوّب مصدر جسيمات ألفا نحو صفيحة رقيقة من الذهب سمكها ٤٠٠ نانومتر، محاطة بشاشة (فلورسنتية) تتوهج بالضوء عند سقوط جسيمات مشحونة عليها. نتائج متوقعة كان رذرفورد واثقا من نتائج التجربة، حيث توقع أن معظم جسيمات ألفا السريعة ستمر من خلال الصفيحة لتصطدم بالشاشة في الطرف الشكل و عند قاذف جسيمات ألفا نحو صفيحة الذهب في تجربة رذرفورد نجد أن معظم الجسيمات قد اخترنت الصفيحة دون أن تتخرف وبعضها الحرف قليلاً عن خساره المستقيم، وبعضها ارتد عن الصفيحة ۲۲ تخرق معظم الحسرات حمد الله بودار تحرف حرف تنة تلم يعقبى الفرات الله الجماعة على العمر 13 مصد الخيرات المرجية الشحنة الاحيات المد) الشعاع ان الحسرات المدرسة احتمات القلا سالة التورتة : الخيرات الجولة عليها مرارة التصليح

نموذج كرة الصلصال
اختراق جسيمات ألفا لصفيحة الذهب في تجربة رذرفورد
المقابل تماما، كما تخترق الرصاصة لوحا من الزجاج. ويزر وكر فورد ذلك بأن صفيحة الذهب لا توجد فيها كمية كافية من الماذة لإيقاف جسيمات ألفا السريعة أو تغيير مسارها، كما أنه لا توجد شحنة موجبة كافية ومتجمعة في مكان واحد في نموذج طومسون الصد جسيمات ألفا بالقوة الكافية لذا؛ فقد اعتقد أن الشحنة الموجبة الموجودة في ذرات الذهب ستحدث تغيرات يسيرة في مسار جسيمات ألفا، كما أن ذلك لن يتكرر كثيرا. لقد كانت هذه الفرضية معقولة إلى حد ما؛ لأن الإلكترونات السالبة تعادل الشحنات الموجبة كما يفترض نموذج طومسون. ولثقته في النتائج المتوقعة من هذه التجربة، أحال رذرفورد تنفيذها إلى أحد طلابه في قسم الدراسات العليا. بروتون . مار جيم ال ألفا - فشل النموذج صدم رذرفورد عندما جاءه تلميذه مندفعا ليخبره أن بعض الشكل ١٠ اعتقد رذرفورد أنه إذا تم جسيمات ألفا الحرفت عن مسارها بزوايا كبيرة، كما في الشكل ۹، فعبر رذرفورد عن اندهاشه بقوله : " إن تصديقنا لذلك يشبه تصديقنا بأنك أطلقت قذيفة قطرها ٦٢,٥ سم نحو مجموعة من المناديل الورقية، فارتدت عنها وأصابتك". فكيف يمكن تفسير ما حدث ؟ ان جسيمات ألفا الموجبة كانت تتحرك بسرعة كبيرة جدا لدرجة أنها احتاجت إلى شحنة موجبة أكبر منها لصدها، بينما كان تصوّر طومسون للذرة في نموذج أن الكتلة والشحنات موزعة بشكل متساو بحيث لا تستطيع الدرة صد جسيمات ألفا. النموذج النووي للذرة كان على رذرفورد وفريقه تفسير هذه النتائج غير المتوقعة، برسم أشكال توضيحية مبنية على نموذج طومسون كما في الشكل ،۱۰، والتي تبين تأثر جسيمات ألفا النواة وصف الذرة حسب نموذج طومسون كما هو موضح فسوف يحدث الحراف قليل في مسار الجينات. بالشحنة الموجبة للذرة والانحراف البسيط لهذه الجسيمات، وفي كل الأحوال، الشكل ۱۱ باهم نموذج النواة فإن التغير الكبير في مسار الجسيمات لم يكن متوقعا . البروتون وجد رذرفورد أن هذا النموذج لا يؤدي إلى نتائج صحيحة، لذلك اقترح نموذجا جديدا، كما في الشكل ،۱۱ ، ينص على أن معظم كتلة الذرة وشحنتها الموجبة تتركز في منطقة صغيرة جدا في الدرة تسمى النواة، وهو ما تم إثبات صحته فيما بعد؛ ففي عام ۱۹۲۰م أطلق العلماء على الجسيم الموجب الشحنة الذي يوجد في نوى جميع الذرات البروتون Proton. بينما نقية حجم الذرة فراغ يحوي الكترونات عديمة الكتلة تقريبا. ماذا عراب؟ كيف وصف رذرفورد نموذجه الجديد ؟ الحديث في تفسير نتائج التجارب، فقد تضمن نموذج رذرفورد وجود كتلة كثافتها كبيرة في الوسط، تتكون من جسمات موجبة الشحنة تسقى السواق درارة التعليم

مسار جسيم ألفا
نموذج النواة الحديث
المشكل ١٢ النواة التي تشكل معظم كتلة الذرة مبيت الانحراف والارتداد الذي لوحظ في التجربة. نموذج الذرة النووية الخطوات التوالة مار جسیم الفا ا ارسم على ورقة بيضاء دائرة يبين الشكل ١٢ التطابق بين نموذج وذرفورد الجديد للذرة والنتائج التجريبية قطرها يساوي عرض الورقة. فمعظم جسيمات ألفا يمكن أن تخترق الصفيحة دون انحراف أو مع الحراف قليل بسبب الفراغ الكبير الموجود في الذرة. وعندما تصطدم جسيمات آلفا اصنع نموذجا للنواة مباشرة بنواة ذرة الذهب التي تحتوي على ٧٩ بروتونا ترتد إلى الخلف بقوة. باستخدام قصاصات صغيرة من الورق الملون بلونين النيوترون رغم الاستحسان الذي لقيه نموذج رذرفورد النووي بعد مراجعة يمثل أحدهما البروتونات. العلماء النتائج التجارب التي توصل إليها، إلا أن بعض النتائج لم تكن متوافقة والآخر النيوترونات، وتبتهما فظهرت تساؤلات جديدة، فعلى سبيل المثال، إلكترونات الدرة عديمة الكتلة في مركز الدائرة باستعمال تقريبا، و حسب نموذج رذرفورد للذرة فإنّ الجسيمات الأخرى الوحيدة في الذرة لاصق، ممثلاً بذلك نواة ذرة هي البروتونات، وقد وجد ان كتل معظم الذرات يساوي ضعف كتلة بروتوناتها الأكسجين التي تتكون من ٨ تقريبا، مما وضع العلماء في مأزق، فإذا كانت الذرة مكونة من إلكترونات بروتونات و ۸ نيوترونات. وبروتونات فقط فمن أين جاء الفرق في كتلة الذرة ) وللخروج من هذا المازق افترضوا وجود جسيمات أخرى في الذرة لمعالجة فرق الكتلة، وقد سميت هذه الجيمات النيوترونات والنيوترون Neutron جسيم له كتلة ماوية الكتلة التحليل ا ما الجسيمات المفقودة في البروتون، ولكنه متعادل كهربائيا. ولأن النيوترون عديم الشحنة ولا يتأثر بالمجال النموذج الذي صمته لذرة المغناطيسي ولا يكون ضوء على شاشة الفلورسنت فقد تأخر اكتشافه أكثر من ٢٠ عاما، حتى تمكن العلماء من إثبات وجود النيوترونات في الذرة. الأكسجين ؟ . ما عدد الجسيمات التي من المفترض أن توجد في النموذج " وأين يجب أن توضع ؟ ي المنزل مانا اول ما الجسيمات الموجودة في نواة الذرة؟ تمت مراجعة نموذج الذرة من جديد لإضافة النيوترونات المكتشفة حديثا إلى النواة. فللذرة في النموذج النووي نواة صغيرة جدا تحوي البروتونات الموجبة الشحنة والنيوترونات المتعادلة الشحنة، أما الإلكترونات المالية الشحنة فيها الحيز المحيط بالنواة. وفي الذرة المتعادلة يتساوى عدد الإلكتروتك مع عدد البروتونات انظر الشكل ١٣ درارة التعليم ٢٤

يبين الشكل التطابق بين نموذج رذرفورد الجديد للذرة والنتائج التجريبية
تمت مراجعة نموذج الذرة من جديد لإضافة النيوترونات المكتشفة حديثا إلى النواة
البروتونات البشر وفات الالكم والباني الشكل ۱۳ درة الكربون الذي عدده الذري ٦ يحتري على ٦ بروتونات و نيوترونات في النواة عن عدد الإلكتر وبات الموجودة في الصراع " المحيط بالنواة البروتونات الحجم ومقياس الرسم إن رسم الذرة النووية بحجم كبير - كما في الشكل ١٣ حدد رذرفورد مكونات النواة عام سابقا - لا يمثل بشكل دقيق حجم النواة الحقيقي بالنسبة إلى الذرة كلها، فإذا كانت ۱۹۱۹م بوصفها جسيمات موجية النواة بحجم كرة تنس الطاولة مثلا فإن الذرة ستكون بقطر ٢٤ كم ولمقارنة الشحنة، وعند استخدام جسيمات حجم النواة بحجم الذرة انظر الشكل .١٤ لعلك الآن عرفت لماذا اخترقت آلما كقذائف تمكن من فصل نواة معظم جسيمات ألفا صفيحة الذهب في تجربة رذرفورد دون أن تواجهها أتي الهيدروجين عن ذرات عناصر معيقات (بسبب وجود فراغات كبيرة فيها تسمح بمرور جسيمات آلفا). تطورات في تعرف بنية الذرة البورون والفلور والصوديوم والألومنيوم والفوسفور والنيتروجين. وقد أطلق رذرفورد على عمل الفيزيائيون في القرن العشرين على نظرية جديدة لتصير كيفية ترتيب نواة ذرة الهيدروجين اسم البروتون، الإلكترونات في الذرة. وكان من الطبيعي التفكير أن الإلكترونات السالبة الشحنة تنجذب إلى النواة الموجبة الشحنة بالطريقة نفسها التي يتجذب بها القمر إلى الأرض. لذا فإن الإلكترونات تتحرك في مدارات حول النواة. وقد قام عرفت في النواة. العالم الفيزيائي نيلز بور Niels Bor بحساب طاقة المستويات المدارات ذرة الهيدروجين بدقة، وقشرت حساباته المعطيات التجريبية لعلماء آخرين. ومع ذلك فقد قال العلماء حينها إن الإلكترونات ثابتة، ولا يمكن توقع حركتها في المدار أو وصفها بسهولة، كما أنه لا يمكن معرفة موقع الإلكترون بدقة في لحظة معينة. وقد آثار عملهم هذا المزيد من البحث والعصف الذهني لدى العلماء حول العالم. الإلكترونات كالموجات بدأ الفيزيائيون محاولة تفسير الطبيعة غير المتوقعة والتي تعني "الأول" عند الإغريق؛ لأن البروتونات هي أول وحدات أساسية للإلكترونات. وبالتأكيد فإن نتائج التجارب التي توصلوا إليها حول سلوك الشكل ١٤ إذا كانت هذه الدائرة التي الإلكترونات تم تفسيرها بوضع نظريات ونماذج جديدة. وكان الحل غير المألوف اعتبار الإلكترونات موجات وليس جسيمات، وقاد ذلك إلى المزيد من النماذج الرياضية والمعادلات التي أدت إلى الكثير من النتائج التجريبية. قطرها ١٣٢ مترا تمثل الإطفاء الخارجي المطرية فإن الدها انتقل تقريبا حجم صرف الجودة (ة) على هذه الصفحة درارزة التعليم Yo

دائرة قطرها 132 متراتمثل الإطار الخارجي للذرة
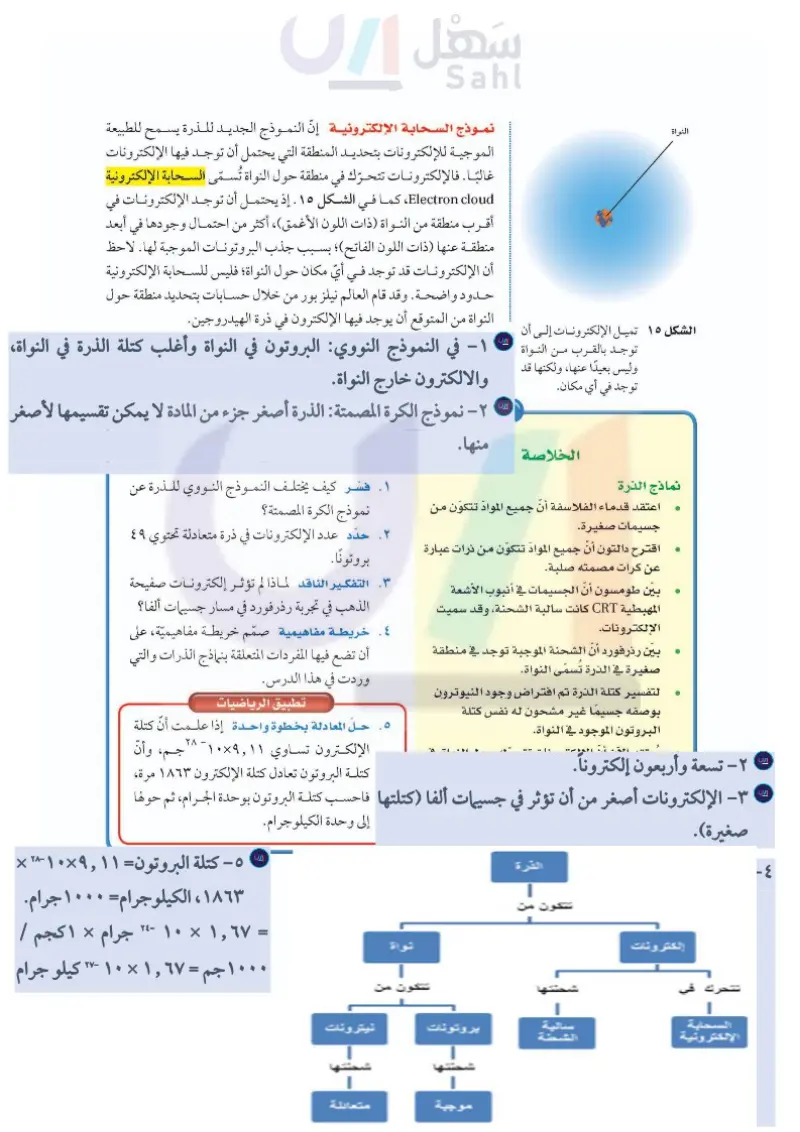
التواق نموذج السحابة الإلكترونية إن النموذج الجديد للذرة يسمح للطبيعة الموجية للإلكترونات بتحديد المنطقة التي يحتمل أن توجد فيها الإلكترونات غالبا، فالإلكترونات تتحرك في منطقة حول النواة تُسمى السحابة الإلكترونية Electron cloud كما في الشكل ١٥ إذ يحتمل أن توجد الإلكترونات في أقرب منطقة من النواة ذات اللون الأغمق أكثر من احتمال وجودها في أبعد منطقة عنها (ذات اللون الفاتح)؛ بسبب حلب البروتونات الموجبة لها، لاحظ أن الإلكترونات قد توجد في أي مكان حول النواة؛ فليس للسحابة الإلكترونية حدود واضحة. وقد قام العالم نیلز بور من خلال حسابات بتحديد منطقة حول النواة من المتوقع أن يوجد فيها الإلكترون في ذرة الهيدروجين. الشكل ١٥ تميل الإلكترونات إلى أن توجد بالقرب من النواة وليس بعيدا عنها، ولكنها قد توجد في أي مكان. مراجعة الدرس الخلاصة اختبر نفسك . . . نماذج الذرة اعتقد قدماء الفلاسفة أن جميع المواد تتكون من جسيمات صغيرة. اقترح دالتون أن جميع المواد تتكون من ذرات عبارة عن كرات مصمته صلبة بين طومسون أن الجسيمات في أنبوب الأشعة المهبطية CRT كانت سالية الشحنة، وقد سميت الالكترونات. بين رذرفورد أن الشحنة الموجبة توجد في منطقة صغيرة في الذرة تسمى النواة التفسير كتلة الذرة تم افتراض وجود النيوترون بوصفه جسيما غير مشحون له نفس كتلة البروتون الموجود في النواة يعتقد الآن أن الالكترونات تتحرك حول النواة في سحابة الكترونية. ا فسر كيف يختلف النموذج النووي للذرة عن نموذج الكرة المصمئة ؟ ۲ حدد عدد الإلكترونات في درة متعادلة تحتوي ٤٩ بروتونا. التفكير الناقد لماذا لم تؤثر الكترونات صفيحة الذهب في تجربة رذرفورد في مسار جسيمات ألفا؟ خريطة مقاهيمية صمم خريطة مفاهيمية، على أن تضع فيها المفردات المتعلقة بماذج الذرات والتي وردت في هذا الدرس. تطبيق الرياضيات حل المعادلة بخطوة واحدة إذا علمت أن كتلة الإلكترون تساوي ۹,۱۱×۱۰ ۲۸ جم، وأن كتلة البروتون تعادل كتلة الإلكترون ١٨٦٣ مرة فاحسب كتلة البروتون بوحدة الجرام، ثم حولها إلى وحدة الكيلو جرام. ۲۶ درارة التعليم