أشكال الجزيئات - الكيمياء2-1 - ثاني ثانوي
الفصل1: الحسابات الكيميائية
الفصل2: الإلكترونات في الذرات
الفصل3: الجدول الدوري والتدرج في خواص العناصر
الفصل4: المركبات الأيونية والفلزات
رابط الدرس الرقمي www.ien.edu.sa 5-4 الأهداف تلخص مفهوم نموذج التنافر أشكال الجزيئات بين أزواج إلكترونات التكافؤ .VSEPR تتوقع الشكل وزاوية الرابطة في الجزيء. 1 تعرف التهجين. مراجعة المفردات المستوى: منطقة ثلاثية الأبعاد Molecular Shapes الفكرة الرئيسة يستعمل نموذج التنافر بين أزواج إلكترونات التكافؤ VSEPR لتحديد شكل الجزيء. الربط مع الحياة لعلك يومًا دلكت بالونين بشعرك وأنت تلعب. هل رأيت كيف يتنافر البالونان بسبب شحنتيهما المتشابهتين، ويبتعد أحدهما عن الآخر؟ وكذلك الحال مع الشحنات؛ فإن أشكال الجزيئات تتأثر بقوى التنافر الإلكترونية. نموذج التنافر بين أزواج إلكترونات التكافؤ VSEPR Model يُحدد شكل الجزيء الكثير من خواصه الفيزيائية والكيميائية، وتحدد الكثافة الإلكترونية الناتجة حول النواة تصف الموقع المحتمل عن تداخل مستويات الإلكترونات المشتركة معا شكل الجزيء. وقد طوّرت أكثر من نظرية لوجود إلكترون. المفردات الجديدة نموذج VSEPR التهجين لشرح تداخل مستويات الترابط، ويمكن استخدامها في توقع شكل الجزيء. كما يمكن معرفة شكل الجزيء عندما نرسم تراكيب لويس له. ويُسمى النموذج المستخدم في تحديد شكل الجزيء نموذج VSEPR التنافر بين أزواج إلكترونات التكافؤ ). ويعتمد هذا النموذج على الترتيب الذي من شأنه أن يقلل التنافر بين أزواج الإلكترونات الرابطة وغير الرابطة حول الذرة المركزية إلى أقصى درجة ممكنة. زاوية الرابطة لفهم نموذج VSEPR على نحو أفضل تخيل بالونات منتفخة بحجوم متماثلة ومربوطا بعضها مع بعض كما في الشكل 18-5؛ حيث يمثل كل بالون منطقة كثافة إلكترونية، وتمنع قوة تنافر منطقة الكثافة الإلكترونية الإلكترونات الأخرى من دخولها. وعندما تتصل مجموعة من البالونات بنقطة مركزية ، وهي تمثل الذرة المركزية فمن الطبيعي أن تأخذ هذه البالونات شكلاً يقلل من التصادم بينهما. تتنافر أزواج الإلكترونات في الجزيء بطريقة مماثلة، وتعمل قوى التنافر هذه على تثبيت مواقع الذرات في الجزيء بحيث تصنع زوايا ثابتة بعضها مع بعض. وتعرف الزاوية بين ذرتين جانبيتين والذرة المركزية بزاوية الرابطة. وتكون قيم زوايا الروابط التي يمكن توقعها بنموذج التنافر بين أزواج إلكترونات التكافؤ مدعومة بأدلة تجريبية. وتؤثر أزواج الإلكترونات غير الرابطة أيضًا في تحديد شكل الجزيء؛ إذ تحتل هذه الإلكترونات مستويات أكبر قليلا مقارنة بالإلكترونات المشتركة. لذا تضغط أزواج الإلكترونات غير الرابطة مستويات الربط المشتركة بين الذرات. الشكل 18-5 تبتعد أزواج الإلكترونات في الجزيء بعضها عن بعض قدر ما أمكن ذلك، كما هو مبين في ترتيب البالونات إذ يكون زوجان شكلا خطيًّا، وتكوّن ثلاثة أزواج شكل مثلث مستو، في حين تكوّن أربعة أزواج شكلاً رباعي الأوجه منتظمًا. شكل رباعي الأوجه منتظم مثلث مستو شكل خطي وزارة التعليم Ministry of Education 2024-1446 196

الربط مستو Trigonal planner علم الأحياء يعد شكل جزيئات الطعام عاملا مهما في تحديد طعمها، حيث تغطي براعم التذوق سطح اللسان، ويحتوي كل برعم ما بين 50 إلى 100 من خلايا مستقبلات الذوق. المفردات وتحدد خلايا مستقبلات التذوق 5 نكهات هي الحلو والمر والمالح والحامض ونكهة طعم أصل الكلمة جلوتومات الصوديوم الأحادية MGS. وتستجيب كل خلية مستقبلة للذوق نكهة واحدة فقط. مثلث تتحدد أشكال جزيئات الطعام اعتمادًا على تركيبها الكيميائي. وحينما يدخل الجزيء نسيج من أصل لاتيني trigonum، التذوق يجب أن يكون له الشكل الصحيح لتتمكن كل خلية عصبية من تمييزه، وإرسال وتعني شكلًا له ثلاث زوايا في رسالة إلى الدماغ الذي يحللها بوصفها نكهة معينة. وعندما ترتبط هذه الجزيئات بمستقبلات سطح مستو و الطعم الحلو يكون مذاقها حلوا. وكلما ازداد عدد جزيئات الطعام المرتبطة بمستقبلات الطعم الحلو زادت حلاوة الطعام. فالسكر والمحليات المصنعة ليست الجزيئات الحلوة الوحيدة؛ فبعض البروتينات الموجودة في الفاكهة جزيئات حلوة الطعم. ولقد تم إدراج بعض أشكال الجزيئات المعروفة في الجدول 56. التهجين Hybridization . الشكل 19-5 تشغل إلكترونات ذرة الكربون يحدث التهجين عند دمج شيئين معًا، حيث يكون للشيء الهجين خواص كلا الشيئين معًا. الموجودة في المستويات 2s و 2p فالسيارات الهجينة مثلا تستخدم الكهرباء والجازولين مصادر للطاقة. وخلال الترابط مستويات مهجنة من نوع sp3. الكيميائي يخضع العديد من المستويات الذرية لعملية التهجين. ولفهم ذلك، ادرس لاحظ أن قيمة طاقة المستويات رابطة جزيء الميثان .. فلذرة الكربون 4 إلكترونات تكافؤ ، وتوزيعها الإلكتروني هو المهجنة تعادل متوسط طاقة وضع Hel222p2. وربما تتوقع أن يرتبط الإلكترونان المنفردان من p بذرات أخرى، وأن تبقى مستويات S و p الأصلية. وتبعا إلكترونات 2s أزواجًا غير مرتبطة . ولكن يحصل لذرات الكربون عملية التهجين، حيث لنظرية VSEPR فإن الشكل تختلط المستويات الفرعية لتكوّن مستويات مهجنة جديدة متماثلة. الرباعي الأوجه المنتظم يقلل يبين الشكل 19-5 المستويات الهجينة في ذرة الكربون، حيث يحتوي كل مستوى مهجن على إلكترون التنافر بين المستويات المهجنة في واحد يمكن أن يشترك به مع ذرة أخرى، ويُسمى بالمستوى المهجن sp لأنه يتكون من المستوى s وثلاثة مستويات p. ويعد الكربون أشهر العناصر التي تخضع لعملية التهجين. ويكون عدد المستويات التي حدد كم وجها يحتوي شكل جزئ تختلط معا وتكوّن المستوى المهجن مساويًا لمجموع أعداد أزواج الإلكترونات، كما في الجدول 6-5. الميثان الناتج عن مستويات sp3. بالإضافة إلى ذلك يكون عدد المستويات المهجنة الناتجة مساويًا عدد المستويات المتداخلة. فعلى سبيل المثال، لـ AICI ثلاثة أزواج من الإلكترونات، ويتوقع نموذج VSEPR أن يكون S شكل الجزيء مثلثًا مستويًا . وينتج هذا الشكل عند تداخل المستوى الفرعي s مع مستويين فرعيين من p في الذرة المركزية Al وتكوين ثلاثة مستويات هجينة متشابهة من نوع sp. تحتل الأزواج غير المرتبطة مستويات مهجنة أيضًا. قارن بين المستويات المهجنة في HO و BeCl الموجودة في الجدول 56 حيث يحتوي كل من المركبين على ثلاث ذرات . فلماذا يحتوي جزيء HO على مستويات sp؟ هناك زوجان غير مرتبطين على ذرة الأكسجين المركزية في HO 6 لذا يجب أن يكون هناك أربعة مستويات مهجنة اثنان للربط واثنان لأزواج غير مرتبطة. تذكر أن الرابطة التساهمية المتعددة تتكون من رابطة سيجما واحدة، ورابطة باي أو أكثر. تحتل إلكترونات رابطة سيجما فقط مستويات مهجنة مثل sp و spa ، أما بقية مستويات p غير المهجنة فتكوّن روابط باي (T) . وإذا علمت أن الروابط التساهمية الأحادية والثنائية والثلاثية تحتوي على مستوى مهجن واحد . لذا فإن CO يحتوي على رابطتين ثنائيتين ويكون المستوى المهجن من نوع sp. ماذا قرأت ؟ اذكر عدد الإلكترونات المتوافرة للترابط في المستوى المهجن sp3. جزيء CH. H: sp 3 H Sp3 CH4 sp 3 sp 3 H :H sp3 p? s2 الكربون الطاقة وزاره العليم 197 Ministry of Education 2024-1446

مثلث مستو
كم وجها يستوي شكل جزيء الميثان الناتج عن مستويات SP2
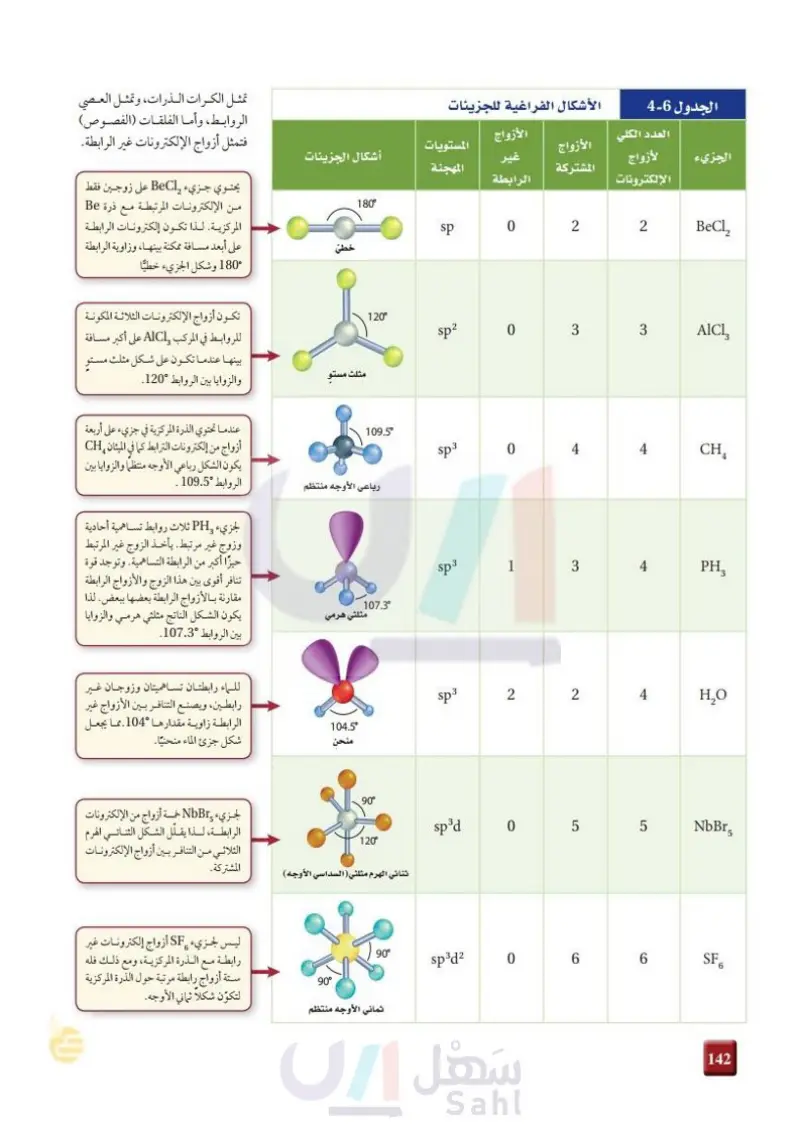
تمثل الكرات الذرات، وتمثل العصي الروابط، وأما الفلقات (الفصوص) فتمثل أزواج الإلكترونات غير الرابطة. يحتوي جزيء BeCl على زوجين فقط من الإلكترونات المرتبطة مع ذرة Be المركزية. لذا تكون إلكترونات الرابطة على أبعد مسافة ممكنة بينها، وزاوية الرابطة 180° وشكل الجزيء خطيًّا الأشكال الفراغية للجزيئات الجدول 6-5 الجزيء العدد الكلي لأزواج الإلكترونات الأزواج الأزواج المشتركة المستويات غير الرابطة أشكال الجزيئات المهجنة خطى 180° sp 0 2 2 BeCl, 120° مثلث مستو تكون أزواج الإلكترونات الثلاثة المكونة للروابط في المركب AICI على أكبر مسافة بينها عندما تكون على شكل مثلث مستو والزوايا بين الروابط 120 عندما تحتوي الذرة المركزية في جزيء على أربعة أزواج من إلكترونات الترابط كما في الميثان CH يكون الشكل رباعي الأوجه منتظما والزوايا بين رباعي الأوجه منتظم الروابط °109.5 . لجزيء PH ثلاث روابط تساهمية أحادية وزوج غير مرتبط. يأخذ الزوج غير المرتبط حيزًا أكبر من الرابطة التساهمية. وتوجد قوة تنافر أقوى بين هذا الزوج والأزواج الرابطة مقارنة بالأزواج الرابطة بعضها ببعض. لذا يكون الشكل الناتج مثلثي هرمي والزوايا بين الروابط °107.3. للماء رابطتان تساهمیتان وزوجان غیر رابطين، ويصنع التنافر بين الأزواج غير الرابطة زاوية مقدارها °104. مما يجعل شكل جزئ الماء منحنيا. لجزيء NbBr خمسة أزواج من الإلكترونات الرابطة، لذا يقلل الشكل الثنائي الهرم الثلاثي من التنافر بين أزواج الإلكترونات المشتركة. sp? 0 3 3 109.5° sp3 0 4 4 الله sp3 1 107.3° مثلثي هرمي 4 الله 3 sp3 2 2 4 الله 104.5° منحن 90° sp3d 120° ثنائي الهرم مثلثي ( السداسي الأوجه) 0 LO 5 AlCl3 CHA PH3 НО LO 5 NbBrs 90° sp3d2 0 6 6 SF 6 90° ثماني الأوجه منتظم ليس لجزيء SF أزواج إلكترونات غير رابطة مع الذرة المركزية، ومع ذلك فله ستة أزواج رابطة مرتبة حول الذرة المركزية لتكوّن شكلا ثماني الأوجه. وزارة التعليم Ministry of Education 2024-1446 198

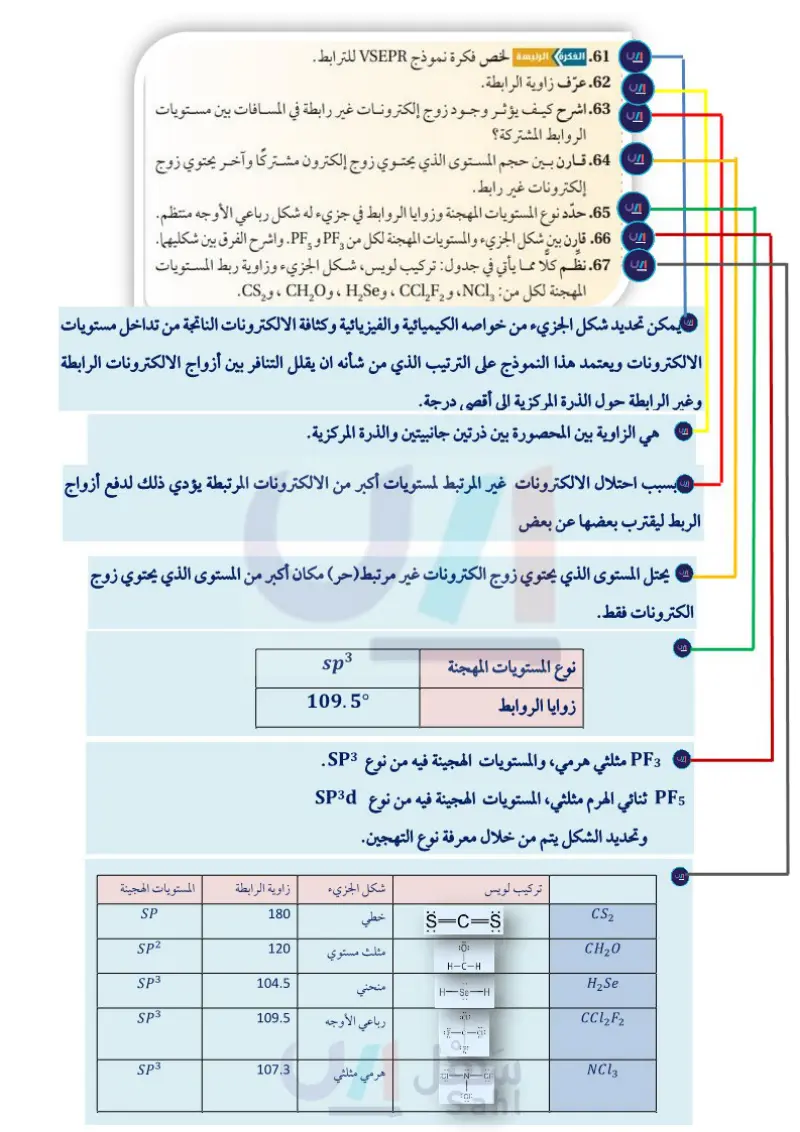
مثال 7-5 ما شكل الجزيء؟ ثلاثي هيدريد الفوسفور غاز عديم اللون ينتج عن تعفن المواد العضوية، ومنها السمك. ما شكل جزيء ثلاثي هيدريد الفوسفور ؟ حدّد مقدار زاوية الرابطة والمستويات المهجنة فيه. 1 تحليل المسألة نعلم من المعطيات أن الجزيء ثلاثي هيدريد الفوسفور ، وله 3 ذرات هيدروجين جانبية متصلة بذرة فوسفور مركزية. 2 حساب المطلوب × 1 atom P 5 إلكترونات تكافؤ latom P حدد العدد الكلي للأزواج المرتبطة + x 3atemi 1 إلكترون تكافؤ = 8 إلكترونات تكافؤ. H ارسم شكل لويس باستخدام زوج من الإلكترونات بين كل ذرة هيدروجين وذرة فوسفور مركزية، وضع الزوج غير الرابط على ذرة الفوسفور. Latom H 8 الكترونات = 4 أزواج 2 إلكترون/ زوج بل H H H الشكل الجزيئي H-P-H → H الشكل الجزيئي مثلث هرمي ويكون مقدار زاوية الرابطة 1070 ، ونوع التهجين sp3 في المستويات المهجنة. تقويم الإجابة كل أزواج الإلكترونات مستخدمة، وكل ذرة لها التوزيع الإلكتروني المستقر. مسائل تدريبية ما شكل الجزيء، ومقدار زاوية الرابطة، والمستويات المهجنة في كل مما يأتي: BF3.56 + OCI₂.57 BeF2.58 60. تحفيز ما شكل أيون " وقيمة زاوية الرابطة ونوع التهجين؟ 4 تركيب لويس CF1.59 التقويم 4-5 الخلاصة 61. الفكرة الرئيسة لخص فكرة نموذج VSEPR للترابط . ينص نموذج VSEPR على 62. عرّف زاوية الرابطة. أن أزواج الإلكتـــرونــات : 63. اشرح كيف يؤثر وجود زوج إلكترونات غير رابطة في المسافات بين مستويات يتنافر بعضها مع بعض الروابط المشتركة؟ 64. قارن بين حجم المستوى الذي يحتوي زوج إلكترون مشتركًا وآخر يحتوي زوج وتحدد شكل الجزيء وزوايا الترابط فيه. إلكترونات غير رابط . 65. حدّد نوع المستويات المهجنة وزوايا الروابط في جزيء له شكل رباعي الأوجه وجه منتظم. 66. قارن بين شكل الجزيء والمستويات المهجنة لكل من PF و PF. واشرح الفرق بين شكليهما. 3 5 يفسّر التهجين أشكال الجزيئات المعروفة من خلال 67. نظم كلا مما يأتي في جدول: تركيب لويس، شكل الجزيء وزاوية ربط المستويات مستويات التهجين المتكافئة . المهجنة لكل من : NCI ، و ، و ، و CHO ، و CS. 6 6 199 واد التعليم Ministry of Education 2024-1446

قارن بين شكل الجزيء والمستوىات المهجنة لكل من PF و 5 PF واشرح الفرق بين شكليهما
عنوان جديد 14نظِّم كلًّ مما يأتي في جدول: تركيب لويس، شكل الجزيء وزاوية ربط المستوىات المهجنة لكل من: