قانون سرعة التفاعل - الكيمياء - خامس اعدادي
الفصل الأول: تطور المفهوم الذري
الفصل الثاني: قوى الترابط والأشكال الهندسية للجزيئات
الفصل الثالث: الجدول الدوري وكيمياء العناصر الانتقالية
الفصل الرابع: المحاليل Solutions
الفصل الخامس: الحركيات الكيميائية
الفصل السادس: الحوامض والقواعد والأملاح Acids, Bases and Salts
الفصل السابع: كيمياء البوليمرات Polymer Chemistry
الفصل الثامن: الهيدروكاربونات الأروماتية Aromatic Hydrocarbons

قانون سرعة التفاعل
تمرين: للتفاعل الغازي الآتي : C A + B وجد بالتجربة ان قانون سرعته Rate = K [A] [B] لذا فمرتبة هذا التفاعل

قانون السرعة ومراتب بعض التفاعلات
مرتبة التفاعل في قانون سرعة التفاعل قد لا تتوافق مع عدد مولات ذلك التفاعل
التفاعل من المرتبة الصفرية
تحديد مراتب التفاعل
تمرين: حدد مراتب المتفاعلات والمرتبة ت العامة لكل من التفاعلات الأتية :
مثال: التفاعل الأتي يجري عند درجة حرارة معينة : 2 N₂O + 02 تم قياس سرعة التفاعل عند تراكيز مختلفة من المادة المتفاعلة NO وتم الحصول على البيانات الواردة في الجدول ادناه.

حل مثال: حدد مرتبة المتفاعل واستنتج قانون سرعة التفاعل والمرتبة العامة له
تمرين: للتفاعل الغازي الاتي : C A+B- وجد بالتجربة ان قانون سرعته = 2 K [A] [B] Rate فاذا ما جعل تركيز A ثلاثة امثاله وتركيز B ضعفه فستزداد سرعة التفاعل بمقدار :
تمرين: التفاعل الغازي الاتي 2NO + 2H₂→N₂ + 2H₂O Rate = K [NO] [H] له قانون السرعة الآتي : فاذا ما قلل تركيز NO الى النصف وزيد تركيز H الى ثلاثة اضعافه فالتغير في سرعة التفاعل بالنسبة للسرعة ا
ايجاد قيمة ثابت سرعة التفاعلايجاد قيمة ثابت سرعة التفاعل
مثال: احسب قيمة ثابت السرعة للتفاعل في المثال 5-4
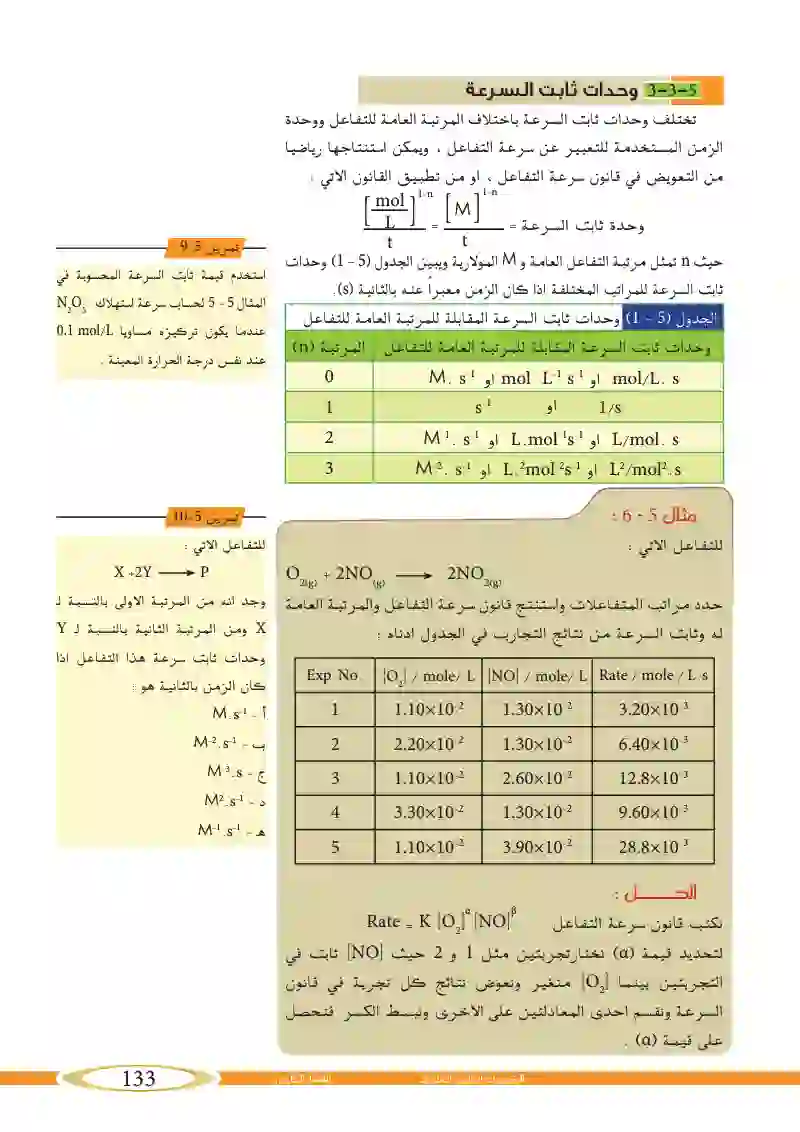
وحدات ثابت السرعة
تمرين5_9: استخدم قيمة ثابت السرعة المحسوبة في المثال 5 - 5 لحساب سرعة استهلاك NO عندما يكون تركيزه مساويا /mol. عند نفس درجة الحرارة المعينة .
تمرين: للتفاعل الآتي : X+2YP وجد انه من المرتبة الأولى بالنسبة لـ ومن المرتبة الثانية بالنسبة لـ Y وحدات ثابت سرعة هذا التفاعل اذا كان الزمن بالثانية هو :
مثال6_5: للتفاعل الاتي : حدد مراتب المتفاعلات واستنتج قانون سرعة التفاعل والمرتبة العامة له وثابت السرعة من نتائج التجارب في الجدول ادناه :

حل مثال: حدد مراتب المتفاعلات واستنتج قانون سرعة التفاعل والمرتبة العامة له وثابت السرعة من نتائج التجارب في الجدول ادناه :
تمرين5_11: للتفاعل الاتي : CH3COOCH2-OH→CH COO +CH₂OH ومن نتائج التجارب الثلاثة في الجدول ادناه





