قوانين سرعة التفاعل الكيميائي - الكيمياء2-2 - ثاني ثانوي
الفصل1: حالات المادة
الفصل2: الطاقة والتغيرات الكيميائية
الفصل3: سرعة التفاعلات الكيميائية
الفصل4: الاتزان الكيميائي
回回 www.ien.edu.sa 3-3 الأهداف قوانين سرعة التفاعل الكيميائي تكتب العلاقة بين سرعة Reaction Rate Laws التفاعل والتركيز. تحدد رتبة التفاعل الكيميائي الفكرة الرئيسة قانون سرعة التفاعل عبارة عن علاقة رياضية - يمكن تحديدها بالتجربة تربط بين سرعة التفاعل وتركيز المادة المتفاعلة. بمقارنة السرعات الابتدائية. الربط مع الحياة عندما يزداد انهمار المطر تزداد سرعة جريان الماء فوق سطح الأرض. وبالطريقة نفسها، عندما يزيد الكيميائي تركيز المواد المتفاعلة تزداد سرعة التفاعل. مراجعة المفردات المتفاعلات : المواد التي يبدأ بها التفاعل الكيميائي. المفردات الجديدة قانون سرعة التفاعل ثابت سرعة التفاعل رتبة التفاعل كتابة قوانين سرعة التفاعلات Writing Reaction Rate Laws تعلمت من قبل كيفية حساب متوسط السرعة للتفاعل الكيميائي. وكلمة (متوسط rate) مهمة؛ لأن معظم التفاعلات الكيميائية تتناقص سرعتها عند استهلاك المواد المتفاعلة، ويقل عدد الجسيمات المتوافرة للتصادم. لقد وضع الكيميائيون نتائج نظرية التصادم في معادلة سميت قانون سرعة التفاعل، وهو يعبر عن العلاقة بين سرعة التفاعل الكيميائي وتركيز المواد المتفاعلة. فعلى سبيل المثال، يعد التفاعل AB تفاعلا من خطوة واحدة، ويعبر عن قانون سرعة تفاعله على النحو الآتي: R= k[A] R يمثل سرعة التفاعل، [۸] تركيز المادة المتفاعلة بينما k هو ثابت سرعة التفاعل يعبر عن سرعة التفاعل بخطوة واحدة بحاصل ضرب كمية ثابتة في تركيز المادة المتفاعلة. والرمز k قيمة عددية ثابتة تسمى ثابت سرعة التفاعل وتربط هذه القيمة العددية سرعة التفاعل بتركيز المواد المتفاعلة عند درجة حرارة معينة. وثابت السرعة قيمة محددة لكل تفاعل، وله وحدات قياس مختلفة مثل: Lmol2.5 ، أو Lmol.s ، أو s. ويجب تحديد قانون سرعة التفاعل تجريبيا، كما هو موضح في الشكل .313 وزارة التعليم Mini349 Education 2073-1445 كروماتوجرافيا الغاز 10 15 20 الشكل 13-3 يتم سحب عينات من خليط التفاعل على فترات منتظمة لتحديد سرعة التفاعل في أثناء حدوثه، ثم تحقن هذه العينات فورا في جهاز الكروماتوجرافيا، الذي يقوم بتعرف مكوناتها، ثم فصل بعضها عن بعض.

كتابة قوانين سرعة التفاعلات
أهداف درس قوانين سرعة التفاعل الكيميائي
كروماتوجرافيا الغاز
350 الشكل 14-3 يبين الرسم يبين قانون السرعة أن سرعة التفاعل تتناسب طرديا مع التركيز المولاري للمركب A. كما أن ثابت سرعة التفاعل لا يتغير مع التركيز ، ولكنه يتغير مع تغير درجة الحرارة، وتعني القيمة الكبيرة لـ k البياني العلاقة المباشرة بين أن A يتفاعل بسرعة لتكوين B. تركيز H202 وسرعة التحلل. سرعة التفاعل الابتدائية مقابل (H2O) سرعة التفاعل الابتدائية 0.200 0.400 0.600 0.800 Rx 105 (mol/1-S) 3.00 2200 1.00 قوانين سرعة التفاعل من الرتبة الأولى يُفهم من المعادلة الرياضية لسرعة التفاعل [R = [A أن التعبير [A] يعني [A] . ويعرف الرقم العلوي الذي يمثل الأس للمادة المتفاعلة A برتبة التفاعل، والتي يمكن تحديدها من خلال معرفة تأثير التغير في تركيز المادة المتفاعلة على سرعة التفاعل. فعلى سبيل المثال، يُعبّر عن قانون سرعة تفاعل تحلل فوق أكسيد الهيدروجين H2O2 بالمعادلة : [R = k [H2O2 ولأن سرعة التفاعل تتناسب طرديا مع تركيز H2O2 مرفوعة إلى الأس 1 أي: '[H2O2] فإن تحلل H2O2 هو تفاعل من الرتبة الأولى، لذلك فإن سرعة التفاعل ستتغير التغير نفسه في تركيز H202. فإذا انخفض تركيز 2 H2O إلى النصف فإن سرعة التفاعل ستنخفض أيضًا بمقدار النصف. اختبار الرسم البياني طبق استعمل الرسم لتحديد تذكر أنه يتم تحديد سرعة التفاعل من البيانات التجريبية ولأن رتبة التفاعل تعتمد على سرعة التفاعل عندما سرعة التفاعل فإنه يترتب على ذلك أن رتبة التفاعل تحدد تجريبيًّا أيضًا. وأخيرًا، ولأن ثابت السرعة k يصف سرعة التفاعل، فإنه يجب تحديده تجريبيا أيضًا. ويبين الشكل 14-3 كيف تتغير سرعة التفاعل الابتدائية لتحلل H2O2 مع التغير في تركيز H2O2. .[H202] = 1.5 mol/L ماذا قرأت؟ استنتج إذا كانت رتبة المادة المتفاعلة في تفاعل كيميائي من الرتبة الأولى، فكيف تتغير سرعة التفاعل إذا تضاعف تركيز المادة المتفاعلة ثلاثة أضعاف؟ قوانين سرعة التفاعل لرتب أخرى الرتبة الكلية للتفاعل الكيميائي هي ناتج جمع رتب المواد المتفاعلة في التفاعل الكيميائي. ومن المعلوم أن الكثير من التفاعلات ـ وبخاصة تلك التي تحتوي على أكثر من مادة متفاعلة - ليست من الرتبة الأولى لتتفحص الشكل العام لتفاعل كيميائي مكون من مادتين متفاعلتين، كما هو مبين في المعادلة الآتية؛ حيث ترمز a و b في هذه المعادلة الكيميائية للمعاملات. نواتج - aA + bB يكون الشكل العام لسرعة مثل هذا التفاعل كما يأتي: القانون العام لسرعة التفاعل R = k[A] "[B]" حيث [A] و [B] يمثلان تراكيز المواد المتفاعلة، وm و n يمثلان رتب التفاعل. سرعة التفاعل تساوي حاصل ضرب ثابت سرعة التفاعل في تراكيز المواد المتفاعلة كل منها مرفوع للأس (الرتبة) التي يتم تحديدها تجريبيا. إذا حدث التفاعل بين A و B في خطوة واحدة، وتكون معقد نشط واحد فقط فستكون a = m وb = n . وهذا غير محتمل؛ لأن تفاعلات الخطوة الواحدة ليست شائعة فعلى سبيل المثال ، تأمل التفاعل بـ أول أكسيد النيتروجين NO والهيدروجين ،، الموضح في المعادلة الآتية: 2NO(g) + 2H2(g) → N2(g) + 2H2O(g) وزارة التعليم Ministry of Education 2023-1445

قوانين سرعة التفاعل من الرتبة الأولى
قوانين سرعة التفاعل لرتب أخرى
يبين قانون السرعة أن سرعة التفاعل تتناســب طرديا مع التركيز المولاري للمركب .A
استعمل الرسم لتحديد سـرعـــة التفاعل عنـــدماH2O2] = 1.5 mol/L ]
إذا كانت رتبة المادة المتفاعلة في تفاعل كيميائي من الرتبة الأولى، فكيف تتغير سرعة التفاعل إذا تضاعف تركيز المادة المتفاعلة ثلاثة أضعاف؟
وزارة التعليم Mini Education 2073-1445 يحدث هذا التفاعل في أكثر من خطوة، لذا فإن قانون سرعة التفاعل له يكون: [R = [H] [NO ويُحدد قانون السرعة من البيانات التجريبية التي تشير إلى أن السرعة تعتمد على تركيز المواد المتفاعلة على النحو الآتي: إذا تضاعف [NO] مرتين فإن السرعة تتضاعف أربع مرات؛ وإذا تضاعف [H] مرة واحدة فإن السرعة تتضاعف مرة واحدة. يوصف التفاعل بأنه من الرتبة الثانية في NO ، و من الرتبة الأولى في ، وبذلك يكون التفاعل من الرتبة الثالثة. فالرتبة الكلية للتفاعل هي مجموع الرتب لكل مادة متفاعلة (مجموع الأسس)، الذي هو (3 = 1 + 2). ماذا قرأت اشرح كيف يمكنك تحديد الرتبة الكلية للتفاعل من معادلة سرعة التفاعل؟ تحديد رتبة التفاعل Determining Reaction Order تحدد رتبة التفاعل من خلال مقارنة السرعات الابتدائية للتفاعل بتغير تركيز المواد المتفاعلة. إن السرعة الابتدائية تقيس سرعة التفاعل في اللحظة التي يتم فيها إضافة المواد المتفاعلة ذات التراكيز المعروفة، وخلط بعضها ببعض. انظر إلى التفاعل العام الآتي نواتج aA + bB)، وافترض أنه أجري ثلاث مرات بتراكيز مختلفة لكل من A و B ، وأن سرعة التفاعل الابتدائية كما هو مبين في الجدول 2-3 تذكر أن قانون سرعة التفاعل العام لهذا النوع من التفاعلات هو : "[R = k [A][B قارن بين التركيز وسرعة التفاعل في المحاولتين الأولى والثانية من خلال البيانات في الجدول 2-3 لتحديد m رتبة (أس) المادة [A] مع بقاء تركيز المادة B ثابتا، لاحظ أن تركيز المادة A في المحاولة 2 هو ضعف التركيز في المحاولة .1. ولاحظ أيضًا أن سرعة التفاعل في المحاولة 2 قد تضاعفت مرتين، مما يعني أن تفاعل السمادة A أحادي الرتبة. ولأن 2 = 2 ، فلا بد إذن أن تكون قيمة m تساوي 1. وسنستعمل الطريقة نفسها لتحديد قيمة الأس n في المادة [B]. فعند مقارنة تركيز المادة B في المحاولتين الثانية والثالثة سنجد أن تركيزها قد تضاعف في المحاولة الثالثة مع بقاء تركيز المادة A ثابتا، مما يعني زيادة سرعة التفاعل أربع مرات عن المحاولة الثانية. ولأن 4 = "2، فلا بد إذن أن تكون قيمة n تساوي 2. تدل المعلومات السابقة على أن التفاعل للمادة A أحادي الرتبة، بينما التفاعل للمادة B ثنائي الرتبة، وهذا يوصلنا إلى القانون العام الآتي لسرعة التفاعل. [R = k [A][B لذا فإن التفاعل عموما من الرتبة الثالثة (مجموع الأسس 3= 1 + 2). الجدول 2-3 المحاولة بيانات السرعات الابتدائية للتفاعل نواتج - a + bB السرعة الابتدائية التركيز الابتدائي التركيز الابتدائي [B] (M) [A] (M) mol/l.s 0.100 0.100 2.00 x 10-3 1 0.100 0.200 4.00 x 10-3 0.200 0.200 16.00 x 10-3 23

ويحدد قانون السرعة من البيانات التجريبية التي تشير إلى أن السرعة تعتمد على تركيز المواد المتفاعلة
تحديد رتبة التفاعل
اشرح كيف يمكنك تحديد الرتبة الكلية للتفاعل من معادلة سرعة التفاعل؟
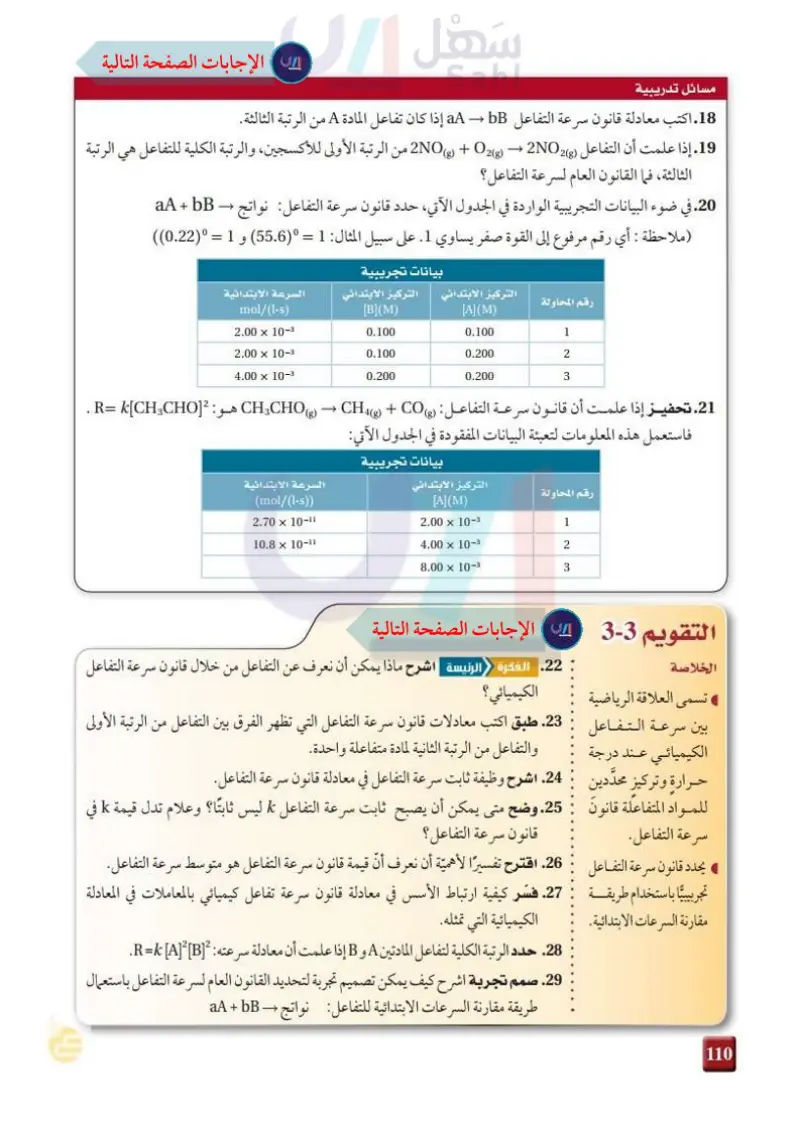
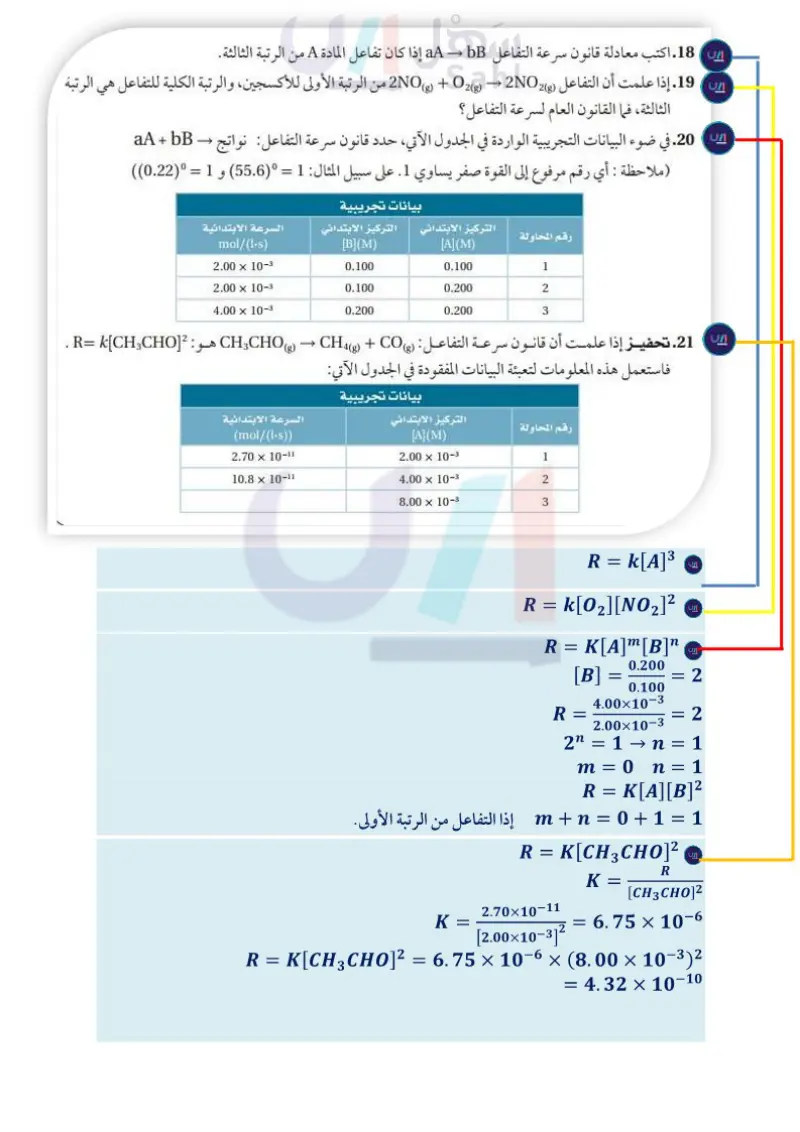
مسائل تدريبية 18. اكتب معادلة قانون سرعة التفاعل aA - bB إذا كان تفاعل المادة A من الرتبة الثالثة. 19. إذا علمت أن التفاعل (NO + 2 + 2NO2 من الرتبة الأولى للأكسجين، والرتبة الكلية للتفاعل هي الرتبة الثالثة، فما القانون العام لسرعة التفاعل؟ 20 . في ضوء البيانات التجريبية الواردة في الجدول الآتي، حدد قانون سرعة التفاعل: نواتج aA + bB (ملاحظة : أي رقم مرفوع إلى القوة صفر يساوي 1. على سبيل المثال: 1 = (55.6) و 1 = (0.22)) بيانات تجريبية التركيز الابتدائي التركيز الابتدائي السرعة الابتدائية رقم المحاولة mol/(1-8) [B](M) [A](M) 2.00 x 10- 0.100 0.100 1 2.00 x 10-3 0.100 0.200 2 4.00 x 10- 0.200 0.200 3 21. تحفيز إذا علمت أن قانون سرعة التفاعل: (CH CHO + C + CO هو: [R= [CH CHO . فاستعمل هذه المعلومات لتعبئة البيانات المفقودة في الجدول الآتي: رقم المحاولة بيانات تجريبية التركيز الابتدائي السرعة الابتدائية (mol/(1-s)) 2.70 x 10-1 10.8 × 10-11 [A](M) 2.00 x 10-3 1 4.00 x 10-3 2 8.00 x 10-3 3 التقويم 3-3 الخلاصة 22. الفكرة الرئيسة اشرح ماذا يمكن أن نعرف عن التفاعل من خلال قانون سرعة التفاعل تسمى العلاقة الرياضية الكيميائي؟ بين سرعة التفاعل 23. طبق اكتب معادلات قانون سرعة التفاعل التي تظهر الفرق بين التفاعل من الرتبة الأولى الكيميائي عند درجة والتفاعل من الرتبة الثانية لمادة متفاعلة واحدة. حرارة وتركيز محددين 24. اشرح وظيفة ثابت سرعة التفاعل في معادلة قانون سرعة التفاعل. للمواد المتفاعلة قانون 25. وضح متى يمكن أن يصبح ثابت سرعة التفاعل ليس ثابتا؟ وعلام تدل قيمة k في قانون سرعة التفاعل؟ سرعة التفاعل. يحدد قانون سرعة التفاعل 26 اقترح تفسيرًا لأهمية أن نعرف أن قيمة قانون سرعة التفاعل هو متوسط سرعة التفاعل. تجربيبيا باستخدام طريقـــــة 27. فسّر كيفية ارتباط الأسس في معادلة قانون سرعة تفاعل كيميائي بالمعاملات في المعادلة مقارنة السرعات الابتدائية. الكيميائية التي تمثله. 28. حدد الرتبة الكلية لتفاعل المادتين A و B إذا علمت أن معادلة سرعته : [R=k [A][B. 29. صمم تجربة اشرح كيف يمكن تصميم تجربة لتحديد القانون العام لـ طريقة مقارنة السرعات الابتدائية للتفاعل نواتج - aA + bB وزارة التعليم Ministry of Education 2073-1445 352

اكتب معادلة قانون سرعة التفاعل aA → bBإذا كان تفاعل المادة Aمن الرتبة الثالثة
الخلاصة تسمى العلاقة الرياضية بين سرعـة الـتـفـاعل الكيميائي عـند درجة ٍ حرارة ٍ وتركيز َّ محددين َ للمواد المتفاعلة قانون سرعة التفاعل
اشرح ماذا يمكن أن نعرف عن التفاعل من خلال قانون سرعة التفاعل الكيميائي؟
وضح متى يمكن أن يصبح ثابت سرعة التفاعل ً kليس ثابتا؟ وعلام تدل قيمة kفي قانون سرعة التفاعل؟
فسر كيفية ارتباط الأسس في معادلة قانون سرعة تفاعل كيميائي بالمعاملات في المعادلة الكيميائية التي تمثله
إذا علمت أن التفاعل ) 2NO(g) + O2(g) → 2N O2(gمن الرتبة الأولى للأكسجين، والرتبة الكلية للتفاعل هي الرتبة الثالثة، فما القانون العام لسرعة التفاعل؟
في ضوء البيانات التجريبية الواردة في الجدول الآتي، حدد قانون سرعة التفاعل
إذا علمــت أن قانون سرعة التفاعــل: ) C H3CHO(g) → C H4(g) + CO(gهــو: . R= k[C H3CHO]2 فاستعمل هذه المعلومات لتعبئة البيانات المفقودة في الجدول الآتي
حدد الرتبة الكلية لتفاعل المادتين Aو Bإذا علمت أن معادلة سرعته: .R =k [A]2[B]
اكتب معادلات قانون سرعة التفاعل التي تظهر الفرق بين التفاعل من الرتبة الأولى والتفاعل من الرتبة الثانية لمادة متفاعلة واحدة
اشرح وظيفة ثابت سرعة التفاعل في معادلة قانون سرعة التفاعل
اقترح تفسيرا لأهمية أن نعرف أن قيمة قانون سرعة التفاعل هو متوسط سرعة التفاعل
اشرح كيف يمكن تصميم تجربة لتحديد القانون العام لسرعة التفاعل باستعمال طريقة مقارنة السرعات الابتدائية للتفاعل
الكيمياء والصحة سرعة التفاعل ودرجة حرارة الجسم تخيل أنك خرجت من المنزل في يوم بارد مسرعًا؛ لأنك متأخر عن المدرسة دون أن تلبس معطفك ، وبدأت تركض، وبعد وقت قصير بدأت ترتجف. إن الارتجاف استجابة تلقائية من قبل الجسم، وهي عملية مهمة للحفاظ على درجة حرارته. درجة حرارة الجسم الطبيعية Normal body temperature درجة حرارة الجسم مقابل سرعة التفاعل تسبب الطاقة الحرارية | زيادة التصادمات بين الأنزيم والجزيء 30 40 50 60 درجة الحرارة C 0 10 20 درجة حرارة الجسم الطبيعية 37°C تقريبا، ولكنها قد تختلف الشكل 1 تقترب درجة حرارة الجسم من 37°C. تؤدي الزيادة باختلاف العمر، أو الجنس أو الوقت، أو مستوى النشاط الذي الكبيرة في الطاقة الحرارية إلى كسر التركيب البنائي للبروتينات يقوم به الشخص؛ فترتفع درجة حرارة جسمك عندما تقوم مما يوقف قدرتها على العمل كما ينبغي. بأنشطة شاقة، أو عندما تكون درجة حرارة الهواء المحيط بك انخفاض درجة حرارة الجسم مرتفعة. ويمكن أن تنخفض درجة حرارة جسمك عند أخذ حمام Hypothermia-Low body remperature بارد أو ارتداء ملابس خفيفة في طقس بارد التفاعلات الكيميائية تسخن الجسم Chemical reactions heat the body عندما تنخفض درجة حرارة الجسم تبدأ غدة تحت المهاد القيام بالعمليات التي من شأنها زيادة تحرير الطاقة الحرارية. فالقشعريرة أو الارتجاف عملية تنتج عن تقلصات سريعة يتم هضم الطعام داخل كل خلية من خلايا الجسم؛ لإنتاج الطاقة للعضلات نتيجة التفاعلات الكيميائية التي تطلق الطاقة التي تُستعمل أو تخزن على شكل جزيئات كبيرة تسمى أدينوسين الحرارية. كما يبدأ الجسم أيضًا إجراءات للحفاظ على الطاقة ثلاثي الفوسفات (ATP). وعند الحاجة إلى الطاقة يتحول ATP الحرارية للجسم، ومن ذلك الحد من تدفق الدم إلى الجلد. إلى أدينوسين ثنائي الفوسفات (ADP) ومجموعة الفوسفات ارتفاع درجة حرارة الجسم (P)، وتتحرر طاقة. طاقة + ATP → ADP + P Hyperthermia-High body temperature تؤدي الطاقة الحرارية المفرطة سواء من البيئة أو بسبب زيادة التفاعلات الكيميائية داخل الجسم إلى استجابة الجسم بواسطة تتطلب مثل هذه التفاعلات إنزيمات خاصة لكي تنظم سرعتها. والإنزيمات بروتينات محفّزة تكون أكثر كفاءة ضمن درجة حرارة التعرق. وينتج ذلك عن توسع الأوعية الدموية القريبة من جسم الإنسان الطبيعية لا يمكن أن تحدث مثل هذه التفاعلات سطح الجلد وتمددها، إضافة إلى زيادة عمل القلب والرئة. ومن شأن هذه العمليات زيادة انتقال الطاقة الحرارية للبيئة. وقد خلق بسرعة تلبي احتياجات الجسم دون مساعدة الإنزيمات ودرجة حرارة قريبة من 37°C. أما خارج نطاق هذه الحرارة، فتصبح الله عز وجل النظام الكامل للتحكم في درجة الحرارة من أجل سرعة التفاعل أبطأ، كما هو مبين في الشكل 1. تنظيم درجة حرارة الجسم Regulating body temperature الحفاظ على حدوث التفاعلات داخل الجسم بالسرعة المثلى. الكتابة في الكيمياء بحث صمم كتيبا للمرضى يقوم المهاد - وهو جزء من الدماغ - بتنظيم درجة حرارة الجسم عن حول العلاج الطبي لانخفاض درجة حرارة الجسم أو طريق نظام التغذية الراجعة المعقد؛ حيث يحافظ النظام على التوازن ارتفاعها. ثم صف المدى الطويلي التأثير هذه الأمراض، وكيف بين الطاقة الحرارية الصادرة عن التفاعلات الكيميائية داخل يمكن منعها ؟ الجسم، والطاقة الحرارية المتبادلة بين الجسم والبيئة المحيطة به. وزارة التعليم Mig fucation 2023-1445

سرعة التفاعل ودرجة حرارة الجسم
مختبر الكيمياء تأثير التركيز في سرعة التفاعل الكيميائي الخلفية تصف نظرية التصادم كيف يؤثر التغير في تركيز إحدى المواد المتفاعلة في سرعة التفاعل الكيميائي؟ سؤال كيف يؤثر تركيز المواد المتفاعلة في سرعة التفاعل؟ المواد والأدوات اللازمة ماصة مدرجة سعتها 10mL مالئة ماصة ماء مقطر حامل أنابيب اختبار شريط ماغنسيوم ورق صنفرة مقص ملاقط ساعة إيقاف حمض الهيدروكلوريك تركيزه 6M وأضف إليها 5m من الماء المقطر، وحرك المزيج، ليصبح تركيز المحلول HCl 0.75 6. اسحب 5mL من حمض HCI الذي تركيزه 0.75 من أنبوب الاختبار رقم 4، ثم خففها بالماء، وتخلص منها في المغسلة. مسطرة بلاستيكية 7. ضع شريطا من الماغنسيوم طوله 1cm باستعمال الملقط في الأنبوب رقم 1. سجل في جدول البيانات الزمن المستغرق بالثانية، حتى تتوقف الفقاعات عن الظهور أنابيب اختبار قطرها mm 25 وطولها mm 150 مرقمة من 1 إلى 4 8 كرر الخطوة رقم 7 مع أنابيب الاختبار الثلاثة المتبقية، وسجل ساق تحريك زجاجية إجراءات السلامة REB20 تحذير: تجنب سحب أي مواد كيميائية عن طريق الفم. تجنب أن يلامس حمض الهيدروكلوريك الجلد أو العيون؛ فهو مادة كاوية. خطوات العمل 1 املأ بطاقة السلامة في دليل التجارب العملية. الزمن اللازم لتوقف الفقاعات عن الظهور. 9. التنظيف والتخلص من النفايات أفرغ المحاليل الحمضية في وعاء التخلص من الأحماض واغسل أنابيب الاختبار وأدوات المختبر جيدا باستعمال الماء، وتخلّص من المواد الأخرى بحسب توجيهات المعلم. ثم أعد الأدوات المختبرية جميعها إلى أماكنها. التحليل والاستنتاج 2. استعمل الماصة المدرجة البلاستيكية لسحب 10mL من حمض 1 الرسم البياني ارسم منحنى بيانيا يمثل تركيز الحمض (على الهيدروكلوريك HCl الذي تركيزه 6، ثم ضعها في أنبوب محور السينات)، وزمن التفاعل على محور الصادات). الاختبار رقم 1. 2 استنتج العلاقة بين تركيز الحمض وسرعة التفاعل الكيميائي 3 اسحب 5mL من حمض HCI الذي تركيزة 6M، باستعمال بالاعتماد على الرسم البياني. الماصة من أنبوب الاختبار رقم 1، ثم ضعها في أنبوب الاختبار .3 ضع فرضية بالاعتماد على نظرية التصادم، وسرعة التفاعل رقم 2، وأضف إليها 5ml من الماء المقطر، ثم حرك المزيج بساق وتركيز المواد المتفاعلة؛ لتفسير النتائج التي حصلت عليها. التحريك، ليصبح تركيز المحلول HCI 3.0 4. تحليل الخطأ قارن نتائج التجربة التي حصلت عليها بالنتائج .4 اسحب 5mL من محلول حمض HCI الذي تركيزه 3.0 من التي حصل عليها الطلبة الآخرون في المختبر، وفسر الاختلافات. أنبوب الاختبار رقم 2، وضعها في أنبوب الاختبار رقم 3. أضف إليها 5 مل من الماء المقطر، وحركها بساق التحريك، ليصبح تركيز المحلول 1.5MHC 5 اسحب 5mL من محلول حمض HCI الذي تركيزه 1.5 الاستقصاء صمم تجربة اعتمادًا على مشاهه اقك والنتائج التي.. حصلت عليها، هل يؤثر التغيّر في دوجة الجوارية في" . من أنبوب الاختبار رقم 3 وضعها في أنبوب الاختبار رقم 4 سرعة التفاعل؟ صمّم تجربة لاختبار فرضية الدورة التعليم Ministry of Education 7023-1445 354

تأثير التركيز في سرعة التفاعل الكيميائي
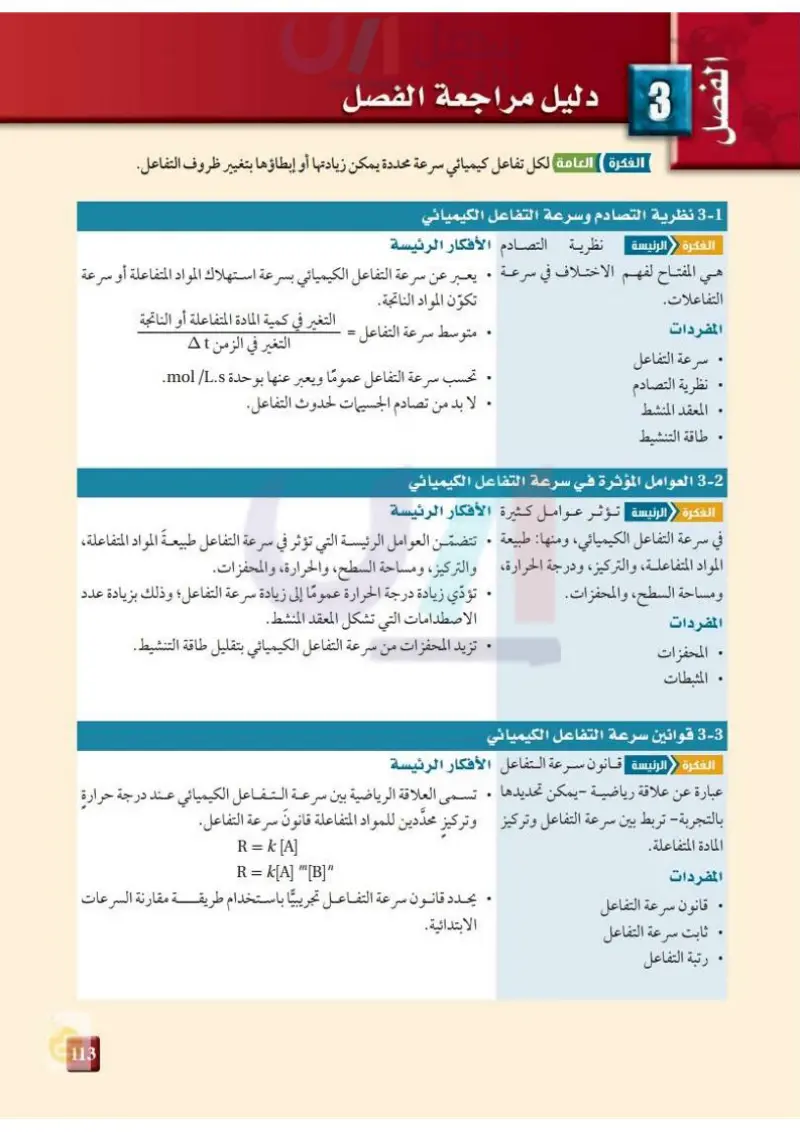
الفصل 3 دليل مراجعة الفصل الفكرة العامة لكل تفاعل كيميائي سرعة محددة يمكن زيادتها أو إبطاؤها بتغيير ظروف التفاعل. 3-1 نظرية التصادم وسرعة التفاعل الكيميائي الفكرة الرئيسة نظرية التصادم الأفكار الرئيسة هي المفتاح لفهم الاختلاف في سرعة . يعبر عن سرعة التفاعل الكيميائي بسرعة استهلاك المواد المتفاعلة أو سرعة التفاعلات. المفردات سرعة التفاعل تكون المواد الناتجة. . متوسط سرعة التفاعل = التغير في كمية المادة المتفاعلة أو الناتجة التغير في الزمن At . نظرية التصادم . المعقد المنشط . طاقة التنشيط . تحسب سرعة التفاعل عمومًا ويعبر عنها بوحدة mol/L.s. . لا بد من تصادم الجسيمات لحدوث التفاعل. 2- العوامل المؤثرة في سرعة التفاعل الكيميائي الفكرة الرئيسة تؤثر عوامل كثيرة الأفكار الرئيسة في سرعة التفاعل الكيميائي، ومنها طبيعة . تتضمن العوامل الرئيسة التي تؤثر في سرعة التفاعل طبيعة المواد المتفاعلة، المواد المتفاعلة، والتركيز، ودرجة الحرارة والتركيز، ومساحة السطح، والحرارة، والمحفزات. ومساحة السطح، والمحفزات. المفردات . المحفزات . تؤدي زيادة درجة الحرارة عموما إلى زيادة سرعة التفاعل؛ وذلك بزيادة عدد الاصطدامات التي تشكل المعقد المنشط . . تزيد المحفزات من سرعة التفاعل الكيميائي بتقليل طاقة التنشيط . . المثبطات 3- قوانين سرعة التفاعل الكيميائي الفكرة الرئيسة قانون سرعة التفاعل الأفكار الرئيسة عبارة عن علاقة رياضية - يمكن تحديدها . تسمى العلاقة الرياضية بين سرعة التفاعل الكيميائي عند درجة حرارة بالتجربة- تربط بين سرعة التفاعل وتركيز وتركيز محددين للمواد المتفاعلة قانون سرعة التفاعل. المادة المتفاعلة. المفردات . قانون سرعة التفاعل • ثابت سرعة التفاعل . رتبة التفاعل R = k [A] R = k[A] "[B]" . يحدد قانون سرعة التفاعل تجريبيًا باستخدام طريقة مقارنة السرعات الابتدائية. وزارة التعليم Minnig lucutions 7023-14

نظرية التصادموسرعة التفاعل الكيميائي
العوامل المؤثرة في سرعة التفاعل الكيميائي
قوانين سرعة التفاعل الكيميائي
التقويم 33 الفصل إتقان المفاهيم 3-1 39. طبق نظرية التصادم لتفسير سبب زيادة سرعة التفاعل بزيادة تركيز المادة المتفاعلة. 40. فسر لماذا تتفاعل المادة الصلبة - التي على شكل مسحوق - 30. ماذا يحدث لتراكيز المواد المتفاعلة والناتجة في أثناء حدوث مع الغاز أسرع من تفاعل المادة الصلبة نفسها إذا كانت التفاعل؟ قطعة واحدة؟ 41. حفظ الأغذية طبق نظرية التصادم لتفسير فساد الطعام 31. اشرح المقصود بمتوسط سرعة التفاعل. 32. كيف يمكن أن تعبر عن سرعة التفاعل الكيميائي ببطء عند وضعه في الثلاجة بالمقارنة ببقائه خارجها عند A B بالاعتماد على تركيز المادة المتفاعلة ؟ وكيف درجة حرارة الغرفة. يمكن مقارنة سرعة التفاعل بالاعتماد على المادة الناتجة B؟ 33. ما دور المعقد المنشط في التفاعل الكيميائي؟ 42 طبق نظرية التصادم لتفسير سبب تفاعل مسحوق الخارصين لإنتاج غاز الهيدروجين أسرع من تفاعل 34. طبق نظرية التصادم لتفسير السبب في عدم تفاعل مادتين قطع كبيرة منه عند وضع كليهما في محلول حمض مع بعضهما البعض؟ إتقان حل المسائل الهيدروكلوريك. 43. يتحلل فوق أكسيد الهيدروجين إلى ماء وغاز الأكسجين 35. يتفاعل الماغنسيوم مع حمض الهيدروكلوريك بحسب المعادلة: بسرعة أكبر عند إضافة ثاني أكسيد المنجنيز. اشرح دور ثاني أكسيد المنجنيز في هذا التفاعل إذا علمت أنه Mg(s) + 2HCl(aq) → H2(g) + MgCl2(aq) لا يُستهلك في التفاعل. إذا كانت كتلة Mg تساوي 68 لحظة بدء التفاعل، وبقي منها ، 4.5 بعد مضي . min 3.00 فما متوسط سرعة إتقان حل المسائل التفاعل بدلالة عدد مولات Mg المستهلكة دقيقة؟ 36. وجد أن سرعة تفاعل كيميائي mol/Ls 10 × 2.25 44. لنفترض أن كمية كبيرة من محلول فوق أكسيد الهيدروجين عند درجة حرارة 322K ، فما مقدار هذه السرعة بوحدة الذي تركيزه 3 قد تحللت لإنتاج mL 12 من غاز mol/L.min؟ إتقان المفاهيم 3-2 الأكسجين خلال 100 ثانية عند درجة حرارة 298K. قدر كمية غاز الأكسجين التي تنتج عن مقدار مماثل من المحلول في 100 ثانية وعند درجة حرارة 308K. 45. استعمل المعلومات في السؤال 44 لتقدير كمية غاز 37. ما دور نشاط المواد المتفاعلة في تحديد سرعة التفاعل الأكسجين التي تنتج عن كمية مماثلة من المحلول خلال 100 ثانية وعند درجة حرارة 318K، ثم قدر الزمن الكيميائي ؟ 38. ما العلاقة بين سرعة التفاعل عموما وتركيز المواد اللازم لإنتاج 12m من غاز الأكسجين عند درجة المتفاعلة؟ حرارة 288K. وزارة التعليم Ministry of Education 2023-1445 356

ماذا يحدث لتراكيز المواد المتفاعلة والناتجة في أثناء حدوث التفاعل؟
يتفاعل الماغنسيوم مع حمض الهيدروكلوريك بحسب المعادلة ما متوســط سرعة التفاعل بدلالة عدد مولات Mgالمستهلكة/دقيقة؟
وجد أن سرعة تفاعل كيميائي 2.25 × 10-2 mol/L.s عند درجة حرارة ،322 Kفما مقـدار هذه السرعة بوحدة mol/L.min ؟
طبّق نظرية التصادم لتفسير سبب زيادة سرعة التفاعل بزيادة تركيز المادة المتفاعلة.
طبّق نظرية التصادم لتفسير سبب تفاعل مسحوق الخارصين لإنتاج غاز الهيدروجين أسرع من تفاعل قطع كبيرة منه عند وضع كليهما في محلول حمض الهيدروكلوريك.
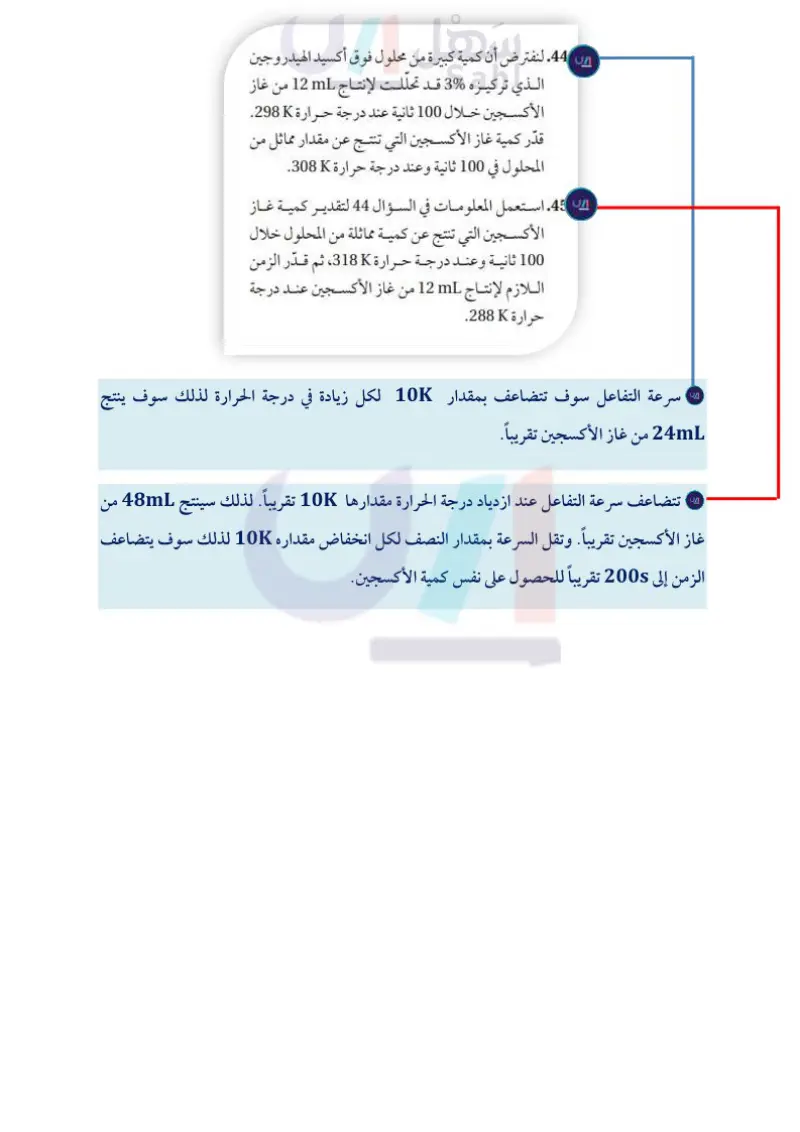
لنفترض أن كمية كبيرة من محلول فوق أكسيد الهيدروجين الذي تركيــزه % ّ 3قد تحللت لإنتــاج 12 mLمن غاز الأكســجين خلال 100ثانية عند درجة حرارة .298 K ّ قدر كمية غاز الأكســجين التي تنتج عن مقد
اشرح المقصود بمتوسط سرعة التفاعل.
كيــف يمكــن أن تعبر عن سرعــة التفاعــل الكيميائي A → Bبالاعتماد على تركيز المــادة المتفاعلة A؟ وكيف يمكن مقارنة سرعة التفاعل بالاعتماد على المادة الناتجة B؟
. ما دور المعقد المنشط في التفاعل الكيميائي؟
طبّق نظرية التصادم لتفسير السبب في عدم تفاعل مادتين مع بعضهما البعض؟
ما دور نشــاط المواد المتفاعلة في تحديــد سرعة التفاعل الكيميائي؟
مــا العلاقة بــين سرعة التفاعــل عموما وتركيــز المواد المتفاعلة؟
فسر لماذا تتفاعل المادة الصلبة - التي على شكل مسحوق- مع الغاز أسرع من تفاعل المادة الصلبة نفسها إذا كانت قطعة واحدة؟
حفظ الأغذية طبّق نظرية التصادم لتفسير فساد الطعام ببطء عند وضعه في الثلاجة بالمقارنة ببقائه خارجها عند درجة حرارة الغرفة.
يتحلل فوق أكسيد الهيدروجين إلى ماء وغاز الأكسجين بسرعة أكبر عند إضافة ثاني أكسيد المنجنيز. اشرح دور ثاني أكسيد المنجنيز في هذا التفاعل إذا علمت أنه لا يُستهلك في التفاعل.
اســتعمل المعلومات في الســؤال 44لتقديــر كمية غاز الأكســجين التي تنتج عن كمية مماثلة من المحلول خلال 100ثانية وعنــد درجة حرارة ، ّ 318 Kثــم قدر الزمن اللازم لإنتــاج 12 mLمن غاز الأكس
تقويم الفصل 3 إتقان المفاهيم 3-3 مراجعة عامة 51. قوم صحة الجملة الآتية: يمكنك تحديد سرعة تفاعل 46. عند اشتقاق قانون سرعة التفاعل، فسر لماذا يجب الاعتماد كيميائي عن طريق معرفة نسبة مولات المواد المتفاعلة في على الأدلة التجريبية أكثر من الاعتماد على المعادلات معادلة موزونة فسّر إجابتك. الكيميائية الموزونة للتفاعل؟ 52. يتناقص تركيز المادة المتفاعلة A من mol/L 0.400 إلى 47. إذا كانت معادلة التفاعل العام هي : A + B AB وقد mol/L 0.384 خلال min 4.00 احسب وجد بالاعتماد على البيانات التجريبية أن رتبة التفاعل سرعة التفاعل خلال هذه الفترة بوحدة mol/L.min. من الرتبة الثانية للمادة المتفاعلة A، فكيف تتغير سرعة التفاعل إذا انخفض تركيز المادة A إلى النصف وبقيت جميع الظروف الأخرى ثابتة؟ إتقان حل المسائل 53. إذا زاد تركيز إحدى المواد الناتجة من mol/L 0.0882 إلى mol/L 0.1446 خلال min 12.0، فما متوسط سرعة التفاعل خلال تلك الفترة؟ 54. يعبر عن التركيز في التفاعل الكيميائي بوحدة mol/L 48. تم الحصول على البيانات التجريبية المدرجة في الجدول وعن الزمن بوحدة . فإذا كان التفاعل الكلي من الرتبة 3-3 من تحلل مركب الآزوميثان CH,NCH عند الثالثة، فما وحدة ثابت سرعة التفاعل؟ درجة حرارة محددة حسب المعادلة: CH3N2CH3(g) →C2H6(g) + N2(g) استعمل البيانات الواردة في الجدول -3-3 لتحديد قانون سرعة التفاعل. الجدول 3-3 تحلل مادة الأزوميثان التفكير الناقد 55 ميز بين المناطق المظللة في الشكل 15-3 عند درجتي الحرارة, و بالاعتماد على عدد الاصطدامات التي تحدث في وحدة الزمن والتي لها طاقة أكبر من أو تساوي رقم التجربة طاقة التنشيط . [CH3N2CH3] السرعة الابتدائية للتفاعل الابتدائي طاقة الجسيم ودرجة حرارته 2.5 × 10 6 mol/L.s 0.012 M 1 5.0 x 10-mol/L.s 0.024 M 2 T, > T T₁ 49. استعمل بيانات الجدول - الحساب قيمة ثابت سرعة التفاعل k . 50. استعمل بيانات الجدول - لتوقع سرعة التفاعل، إذا كان التركيز الابتدائي لـ CH3NCH هو 0.048M ودرجة الحرارة ثابتة. طاقة التنشيط T, طاقة التصادم . الشكل 15-3 وزارة التعليم Mining Education 2073-14

عند اشتقاق قانون سرعة التفاعل، فرّ لماذا يجب الاعتماد على الأدلة التجريبية أكثر من الاعتماد على المعادلات الكيميائية الموزونة للتفاعل؟
تم الحصول على البيانــات التجريبية المدرجة في الجدول 3-3مــن تحلل مركب الآزوميثــان CH3N2CH3عند درجة حرارة محددة حسب المعادلة
قوّم صحة الجملة الآتية: يمكنك تحديد سرعة تفاعل كيميائي عن طريق معرفة نسبة مولات المواد المتفاعلة في معادلة موزونة. فرّ إجابتك.
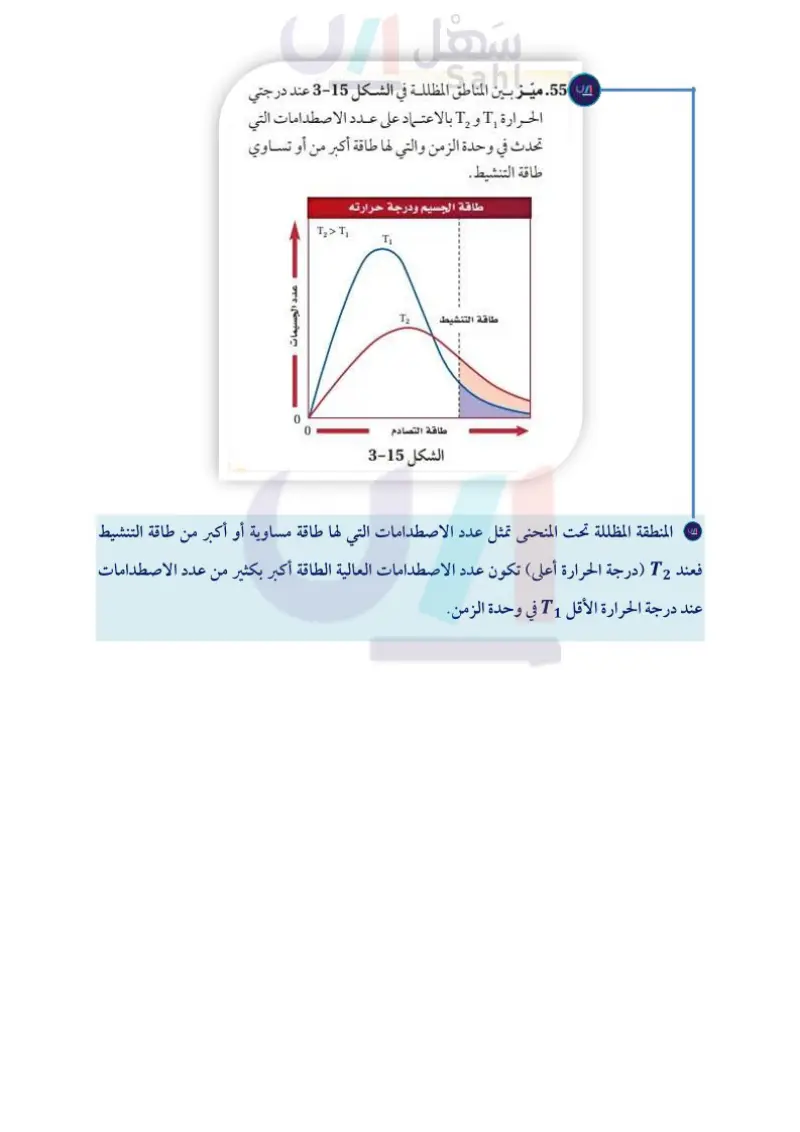
ميز بين المناطق المظللة في الشــكل 3-15عند درجتي الحرارة T1و T2بالاعتماد عــلى عدد الاصطدامات التي تحدث في وحدة الزمن والتي لها طاقة أكبر من أو تساوي طاقة التنشيط
إذا كانت معادلة التفاعل العام هي: A + B ABوقد ُو ِج َد بالاعتماد على البيانــات التجريبية أن رتبة التفاعل مــن الرتبة الثانية للمادة المتفاعلــة ،Aفكيف تتغير سرعة التفاعــل إذا انخفض تركيز
استعمل بيانات الجدول 3-3لحساب قيمة ثابت سرعة التفاعل .
اســتعمل بيانات الجدول 3-3لتوقع سرعة التفاعل، إذا كان التركيــز الابتدائي لـ CH3N2CH3هو ،0.048 M ودرجة الحرارة ثابتة
يتناقــص تركيز المادة المتفاعلة Aمن 0.400 mol/Lإلى 0.384 mol/Lخلال .4.00 minاحســب متوســط سرعة التفاعل خلال هذه الفترة بوحدة mol/L.min
إذا زاد تركيــز إحدى المواد الناتجة من 0.0882 mol/L إلى 0.1446 mol/Lخــلال ،12.0 minفما متوســط سرعة التفاعل خلال تلك الفترة؟
يعبر عن التركيــز في التفاعل الكيميائي بوحدة mol/L وعن الزمن بوحــدة .sفإذا كان التفاعل الكلي من الرتبة الثالثة، فما وحدة ثابت سرعة التفاعل؟
تقويم الفصل 3 56. تأمل مخطط الطاقة لتفاعل ماص للطاقة، مكوّن من | مسألة تحفيز خطوة واحدة، ثم قارن ارتفاع طاقة التنشيط للتفاعل 61. الهيدروكربونات يتحول البروبان الحلقي CH عند الأمامي والتفاعل العكسي. تسخينه إلى بروبين CH = HH. فإذا علمت أن 57. طبق طريقة مقارنة السرعات الابتدائية لتحديد رتبة سرعة التفاعل من الرتبة الأولى للبروبان الحلقي، وكان التفاعل الكيميائي للمادة المتفاعلة X، واكتب مجموعة من ثابت السرعة عند درجة حرارة معينة 105 × 6.22 ، البيانات التجريبية الافتراضية التي تقود إلى استنتاج أن و ثبت تركيز البروبان الحلقي عند mol/L 0.0300، فما تفاعل المادة X من الرتبة الثانية . كتلة البروبين الناتجة خلال min 10.0 في حجم مقداره L 2.50 ؟ 58. طبق نظرية التصادم لتفسير سببين يوضحان أن الزيادة في درجة حرارة التفاعل بمقدار 10K تؤدي غالبًا إلى مضاعفة سرعة التفاعل. 59 ارسم مخططا يبين جميع الاحتمالات للتصادمات بين مراجعة تراكمية جزيئين من المادة المتفاعلة ،A وجزيئين من المادة المتفاعلة 62. ما كتلة كلوريد الحديد III اللازمة لتحضير محلول مائي منه حجمه 1.0L وتركيزه 0.225 B، ثم زد عدد جزيئات A من 2 إلى 4 وارسم جميع احتمالات التصادم التي يتحد فيها A مع .. كم سيزداد 63. ما المعلومات التي يجب معرفتها لحساب الارتفاع في عدد التصادمات التي ينتج عنها اتحاد A مع B؟ وعلام درجة غليان محلول الهكسان في البنزين ؟ يدل ذلك فيما يتعلق بسرعة التفاعل؟ 60. صمم جدولاً لكتابة تراكيز المواد المتفاعلة في المعادلة الناتجة بطاقة المواد المتفاعلة، وهل التفاعل ماص أم طارد الآتية، مبتدثًا بـ 0.100 لكل المتفاعلات، ثم حدد قانون سرعة التفاعل باستعمال طريقة مقارنة السرعات 64. إذا كانت AH لتفاعل ما سالبة، فقارن طاقة المواد للطاقة؟ 358 الابتدائية: نواتج + aa + bB + CD وزارة التعليم Ministry of Education 7073-1445

تأمل مخطط الطاقة لتفاعل ماصّ للطاقة، مكوّن من خطوة واحدة، ثم قارن ارتفاع طاقة التنشيط للتفاعل الأمامي والتفاعل العكسي.
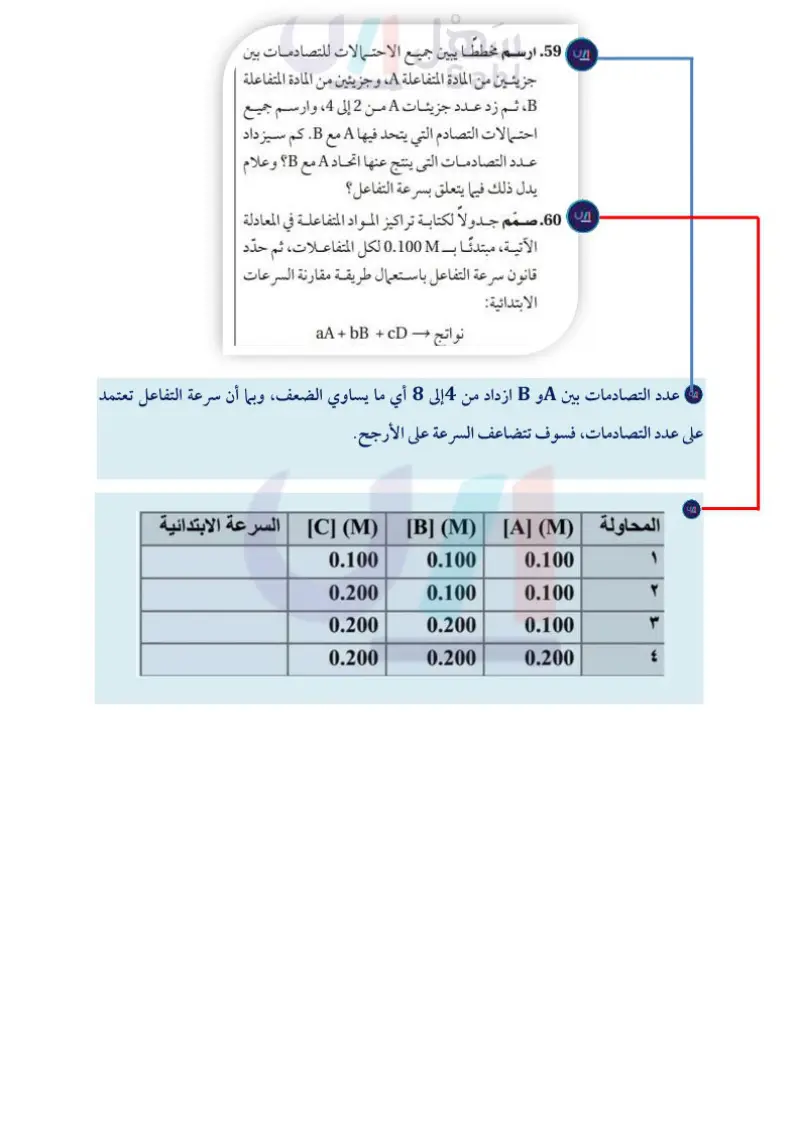
ارسم مخططا يبــين جميع الاحتــمالات للتصادمات بين جزيئين من المادة المتفاعلة ،Aوجزيئين من المادة المتفاعلة وارســم جميع احتمالات التصادم التي يتحد فيها Aمع .Bكم سيزداد عدد التصادمات التى ي
الهيدروكربونــات يتحول البروبــان الحلقي C3H6عند تســخينه إلى بروبــين .CH2 = CHCH3فإذا علمت أن سرعة التفاعل مــن الرتبة الأولى للبروبان الحلقي فما كتلة البروبين الناتجة خلال 10.0 minفي ح
ما كتلــة كلوريد الحديد IIIاللازمة لتحضير محلول مائي منه حجمه 1.0 Lوتركيزه 0.225 M؟
طبق طريقــة مقارنة السرعات الابتدائيــة لتحديد رتبة التفاعل الكيميائي للمادة المتفاعلة ،Xواكتب مجموعة من البيانات التجريبية الافتراضية التي تقود إلى اســتنتاج أن تفاعل المادة Xمن الرتبة الث
طبق نظرية التصادم لتفسير سببين يوضحان أن الزيادة في درجــة حرارة التفاعل بمقــدار ً 10 Kتؤدي غالبا إلى مضاعفة سرعة التفاعل
صمم جدولا لكتابــة تراكيز المــواد المتفاعلة في المعادلة ً الآتيــة، مبتدئا بـ ّ 0.100 Mلــكل المتفاعلات، ثم حدد قانون سرعة التفاعل باســتعمال طريقة مقارنة السرعات الابتدائية
ما المعلومات التي يجب معرفتها لحساب الارتفاع في درجة غليان محلول الهكسان في البنزين؟
إذا كانــت ٍ ∆Hلتفاعل ما ســالبة، فقــارن طاقة المواد ّ الناتجة بطاقة المواد المتفاعلة، وهل التفاعل ماص أم طارد للطاقة؟
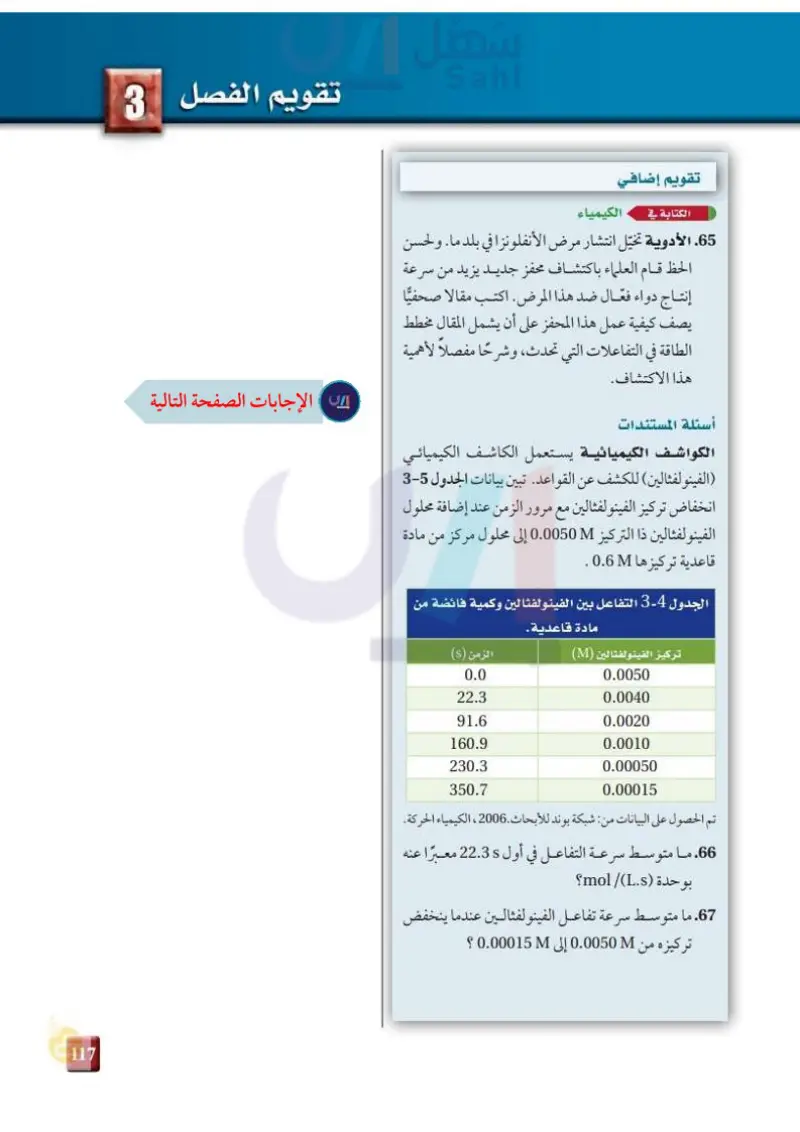
تقويم إضافي الكتابة في الكيمياء 65. الأدوية تخيّل انتشار مرض الأنفلونزا في بلد ما، ولحسن الحظ قام العلماء باكتشاف محفز جديد يزيد من سرعة إنتاج دواء فعّال ضد هذا المرض. اكتب مقالا صحفيا يصف كيفية عمل هذا المحفز على أن يشمل المقال مخطط الطاقة في التفاعلات التي تحدث، وشرحًا مفصلاً لأهمية هذا الاكتشاف. أسئلة المستندات الكواشف الكيميائية يستعمل الكاشف الكيميائي ( الفينولفثالين) للكشف عن القواعد تبين بيانات الجدول 4-3 انخفاض تركيز الفينو لفثالين مع مرور الزمن عند إضافة محلول الفينو لفثالين ذا التركيز 0.0050M إلى محلول مركز من مادة قاعدية تركيزها 0.6 الجدول 4- التفاعل بين الفينولفثالين وكمية فائضة من مادة قاعدية. تركيز الفينولفثالين (M) الزمن (s) 0.0 0.0050 22.3 0.0040 91.6 0.0020 160.9 0.0010 230.3 0.00050 350.7 0.00015 تم الحصول على البيانات من شبكة بوند للأبحاث . 2006 ، الكيمياء الحركة. 66. ما متوسط سرعة التفاعل في أول 22.35 معبرا عنه بوحدة (mol/Ls؟ 67. ما متوسط سرعة تفاعل الفينو لفثالين عندما ينخفض تركيزه من 0.0050 إلى 0.000151 ؟ تقويم الفصل 3 وزارة التعليم Mining Education 2073-1445

اكتب مقالا صحفيًّا يصف كيفية عمل هذا المحفز على أن يشمل المقال مخطط الطاقة في التفاعلات التي تحدث، وشرحًا مفصلاً لأهمية هذا الاكتشاف.
ما متوســط سرعة التفاعل في أول ً 22.3 sمعبرا عنه بوحدة (mol/)L.s؟
ما متوسط سرعة تفاعل الفينولفثالين عندما ينخفض تركيزه من 0.00015 M إلى0.0050 M ؟
اختبار مقنن أسئلة الاختيار من متعدد 1. جميع العبارات الآتية حول سرعة التفاعل الكيميائي صحيحة ما عدا: a السرعة التي يحدث بها التفاعل. .C التغير في تراكيز المواد المتفاعلة خلال وحدة الزمن. 4. أي الوحدات لا تستعمل للتعبير عن سرعة التفاعل؟ M/min .a L/s .b C mol/mL.h mol/L.min .d التغير في تراكيز المواد الناتجة خلال وحدة الزمن. 5. أي أنواع القوى بين الجزيئية الآتية يعد الأقوى؟ d كمية المواد الناتجة المتكونة في كل فترة زمنية 2. ادرس العبارات الآتية: العبارة الأولى من العوامل التي تؤثر في سرعة التفاعل طبيعة المادة المتفاعلة، والتركيز، ومساحة سطح التفاعل، ودرجة الحرارة، والمحفزات. a الرابطة الأيونية. b قوى ثنائية القطب. .C قوى التشتت d الرابطة الهيدروجينية. العبارة الثانية : تزيد المحفزات من سرعة التفاعلات استعمل الأشكال أدناه للإجابة عن السؤالين 6 و 7 . بزيادة طاقة التنشيط العبارة الثالثة: يجب أن تصطدم جسيمات المواد المتفاعلة حتى يحدث تفاعل. أي العبارات السابقة صحيحة ؟ a الأولى والثانية. b الثانية والثالثة. الأولى والثالثة. d الأولى والثانية والثالثة. . D 6. أي العينات تحتوي على جزيئات غاز الأكسجين؟ X .a y b Z 3 ما حجم الماء الذي يجب إضافته إلى 6.0ml من محلول قياسي تركيزه 0.050M لتخفيفه إلى محلول تركيزه d كل من x ولا 7. أي العينات تحتوي على جزيئات فلوريد الماغنسيوم؟ وزارة التعليم Ministry of Education 2023-1445 X .a y .b d كل من x ولا $0.020 M 15 ml .a 9.0 mL .b 6.0 mL .c 2.4 mL .d 360

جميع العبــارات الآتية حول سرعة التفاعــل الكيميائي صحيحة ما عدا:
ادرس العبارات الآتية : العبارة الأولى: من العوامل التى تؤثر في سرعة التفاعل طبيعــة المــادة المتفاعلة، والتركيز، ومســاحة ســطح التفاعل، ودرجة الحرارة، والمحفزات أي العبارات السابقة صحيحة؟
ما حجم الماء الذي يجب إضافته إلى 6.0 mlمن محلول قياسي تركيــزه 0.050 Mلتخفيفــه إلى محلول تركيزه 0.020 M؟
أي الوحدات لا تستعمل للتعبير عن سرعة التفاعل؟
أي أنواع القوى بين الجزيئية الآتية يعد الأقوى؟
أي العينات تحتوي على جزيئات غاز الأكسجين؟
أي العينات تحتوي على جزيئات فلوريد الماغنسيوم؟
أسئلة الإجابات القصيرة 8 افترض أن قانون السرعة العام هو : " [R = [A][B ما رتبة التفاعل لكل من المادة A والمادة B؟ وما رتبة التفاعل الكلية؟ طاقة التفاعل سير التفاعل 9. يبين الشكل أعلاه منحنى طاقة تفاعل. إلام يشير كل رقم من الأرقام المبينة في الرسم؟ 10. المعادلة [R=K[A تصف سرعة تفاعل من الرتبة الأولى. إذا تضاعف تركيز المادة المتفاعلة A فماذا يطراً على سرعة التفاعل؟ أسئلة الإجابات المفتوحة 11. يتفاعل اليود والكلور في الحالة الغازية L + Cl2 - 2ICI فإذا كان ] يساوي 0.400 عند بداية التفاعل وأصبح M 0.300 بعد مضي min 4.00 فاحسب متوسط سرعة التفاعل بوحدة mol/L.min. اختبار مقنن وزارة التعليم Min36 Education 7073-1445

افترض أن قانون السرعة العام هو: .R = ]A] ]B] 3 ما رتبة التفاعل لــكل من المادة Aوالمادة B؟ وما رتبة التفاعل الكلية؟
يتفاعل اليود والكلور في الحالة الغازية: فاحسب متوسط سرعة التفاعل بوحدة .mol/L.min
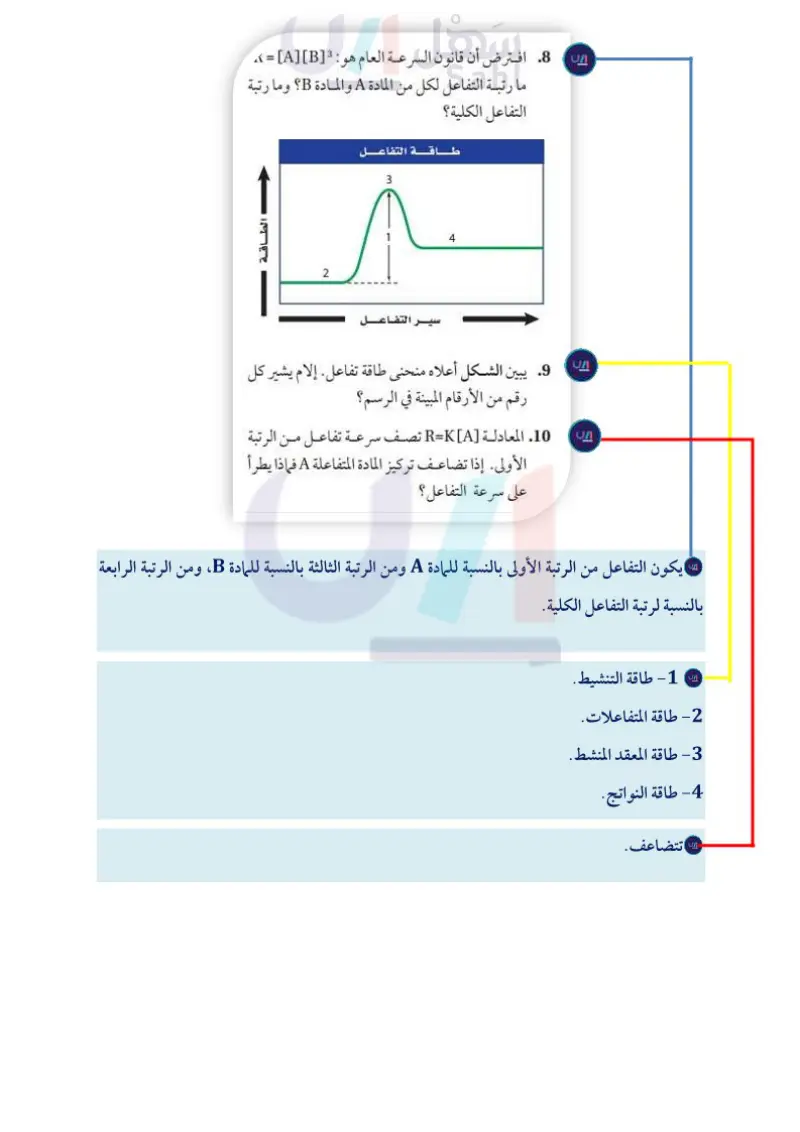
يبين الشكل أعلاه منحنى طاقة تفاعل. إلام يشير كل رقم من الأرقام المبينة في الرسم؟
المعادلــة ] R=K ]Aتصف سرعة تفاعــل من الرتبة الأولى. إذا تضاعف تركيز المادة المتفاعلة Aفماذا يطرأ على سرعة التفاعل؟