التوزيع الإلكتروني - الكيمياء2-1 - ثاني ثانوي
الفصل1: الحسابات الكيميائية
الفصل2: الإلكترونات في الذرات
الفصل3: الجدول الدوري والتدرج في خواص العناصر
الفصل4: المركبات الأيونية والفلزات
رابط الدرس الرقمي 2-3 الأهداف ) التوزيع الإلكتروني تطبق مبدأ باولي ومبدأ Electron Configuration www.ien.edu.sa أوفباو (البناء التصاعدي) الفكرة الرئيسة يُحدد التوزيع الإلكتروني في الذرة باستخدم ثلاث قواعد. وقاعدة هوند لكتابة التوزيع الربط مع الحياة عندما يصعد الطلاب إلى الحافلة يجلس كل منهم في مقعد وحده حتى تُشغل الإلكتروني باستخدام طريقة المقاعد كلها، ثم يأتي آخرون فيشاركونهم الجلوس عليها. وكذلك الإلكترونات تملأ مستويات رسم المربعات، وطريقة الترميز الإلكتروني، وطريقة ترميز الغاز النبيل. الطاقة بالطريقة نفسها. التوزيع الإلكتروني في الحالة المستقرة - توضح المقصود بإلكترونات Ground State Electron Configuration التكافؤ، وترسم التمثيل النقطي يبدو لنا ترتيب إلكترونات ذرات العناصر الثقيلة أمرًا صعبًا، وخصوصًا أن هذه الذرات قد لإلكترونات التكافؤ في الذرة. تحتوي على أكثر من 100 إلكترون. فإذا علمنا أن مستويات هذه الذرات تشبه مستويات ذرة الهيدروجين فإن ذلك يسمح لنا بترتيب إلكترونات هذه الذرات باستخدام قواعد قليلة محددة. مراجعة المفردات يُسمى ترتيب الإلكترونات في الذرة التوزيع الإلكتروني. ولأن الأنظمة ذات الطاقة المنخفضة الإلكترون : جُسيم ذو كتلة أكثر استقرارًا من الأنظمة ذات الطاقة العالية فإن الإلكترونات تميل إلى اتخاذ ترتيب يُعطي صغيرة جدا، سـالــب الشحنة، موجود في كل أشكال المادة، الذرة أقل طاقة ممكنة. ويسمى ترتيب الإلكترونات في الوضع الأقل طاقة والأكثر ثباتًا التوزيع ويتحرك بسرعة في الفراغ المحيط بنواة الذرة. المفردات الجديدة التوزيع الإلكتروني الإلكتروني في الحالة المستقرة للعنصر. وتحكم المبادئ أو القواعد – ومنها مبدأ أوفباو ومبدأ باولي وقاعدة هوند - كيفية ترتيب الإلكترونات في مستويات الذرة. مبدأ أوفبا و ينص مبدأ أو فباو البناء التصاعدي على أن كل إلكترون يشغل المستوى الأقل طاقة. لذا فإن تحديد التوزيع الإلكتروني في الحالة المستقرة يتطلب معرفة ترتيب المستويات الفرعية وفق تزايد طاقاتها. ويعرف هذا التسلسل برسم أو فباو، وهو موضح في الشكل 17-2، مبدأ أو فباو (البناء التصاعدي) حيث يمثل كل صندوق في الشكل مستوًى فرعيًّا . مبدأ باولي قاعدة هوند إلكترونات التكافؤ التمثيل النقطي للإلكترونات 282 65 7p 6d 5f 7s 6p 5d 4f 65 5p 4d 55 4p 3d 4s 30 3p المستويات الثانوية الأخرى. ويمثل كل الشكل 17 يوضح رسم أوفباو طاقة كل مستوى ثانوي مقارنة بطاقة صندوق في الرسم مستوى فرعيًّا. حدّد أي مستوى ثانوي له الطاقة الأكبر: 4d أو 5p؟ 35 2p 25 تسلسل ملء المستويات ازدياد الطاقة وزارة التعليم Ministry of Education 2024-1446 15 88

الجدول 5-2 خواص رسم أوفباو الخاصية مثال طاقة المستويات الفرعية في المستوى الثانوي جميعها متساوية. المستويات الفرعية الثلاثة في المستوى الثانوي 2p جميعها متساوية الطاقة. في الذرة المتعددة الإلكترونات تكون طاقة المستويات الثانوية طاقة المستويات الفرعية الثلاثة في المستوى الثانوي 2p أعلى من طاقة المختلفة ضمن مستوى الطاقة الرئيس الواحد مختلفة. تسلسل زيادة طاقة المستويات الثانوية ضمن مستوى الطاقة الرئيس الواحد هو f ،d ،p ،s المستوى الفرعي 2s فإذا كان 4 = n فسيكون التسلسل لمستويات الطاقة الثانوية .4f ،4d ،4p ،4s تستطيع مستويات الطاقة الثانوية لمستوى رئيس أن تتداخل مع تكون طاقة المستوى الفرعي في المستوى الثانوي 4s أقل المستويات الفرعية الخمسة في المستوى الثانوي 3d. مستويات الطاقة الثانوية ضمن مستوى رئيس آخر. يلخص الجدول - عدة خواص لرسم أو فباو . وعلى الرغم من أن مبدأ أو فباو يصف التسلسل الذي تمتلئ فيه المستويات الفرعية بالإلكترونات إلا أنه من المهم أن نعرف أن الذرات لا تُبنى بإضافة إلكترونًا بعد الآخر. المفردات. طاقة مـن الكــلــمــة الألمــانـيـة aufbauen، والتي تعني يهيئ أو يرتب. مبدأ باولي يمكن تمثيل المستويات الفرعية بمربعات أو دوائر كما يمكن تمثيل الإلكترونات في أصل الكلمة المستويات باستخدام الأسهم في المربعات. ولكل إلكترون اتجاه دوران مرتبط معه، حيث يمثل " أوفباو Aufbau" السهم المتجه إلى أعلى [1] دوران الإلكترون في اتجاه معين، ويمثل السهم المتجه إلى أسفل ] دوران الإلكترون في الاتجاه المعاكس. ويمثل المربع الفارغ مستويًا فرعيا شــــاغـرا، كما يمثل المربع الذي يحتوي على سهم واحد يتجه إلى أعلى [1] مستويًا فرعيًّا بإلكترون واحد، ويمثل المربع الذي يحتوي على سهمين أحدهما يتجه إلى أعلى والآخر إلى أسفل [1] مستويًا فرعيًا ممتلئًا . ينص مبدأ باولي على أن عدد إلكترونات المستوى الفرعي الواحد لا يزيد عن إلكترونين ويدور كل منهما حول نفسه باتجاه معاكس للآخر. واقترح الفيزيائي النمساوي أدخل معلومات من هذا باولي Pauli (1900 - 1958م) هذا المبدأ بعد ملاحظة الذرات في حالات الإثارة. ويُمثل القسم في مطويتك. المستوى الفرعي الذي يحتوي على زوج من الإلكترونات ذات الدوران المتعاكس بـ ] . ولأن كل مستوى فرعي لا يستطيع احتواء أكثر من إلكترونين فإن الحد الأعلى للإلكترونات في مستوى الطاقة الرئيس يساوي 2n2. قاعدة هوند إن حقيقة تنافر الإلكترونات المشحونة بشحنة سالبة لها تأثير كبير في توزيع الإلكترونات في مستويات فرعية متساوية الطاقة وتنص قاعدة هوند Hund's على أن الإلكترونات تتوزع في المستويات الفرعية المتساوية الطاقة بحيث تحافظ على أن يكون لها الاتجاه نفسه من حيث الدوران، قبل أن تشغل الإلكترونات الإضافية ذات اتجاه الدوران المعاكس المستويات نفسها. فعلى سبيل المثال، تُملأ مستويات 2p الفرعية الثلاثة بإلكترونات منفردة، ثم تحدث عملية الازدواج. ويوضح الشكل الآتي تسلسل دخول ستة إلكترونات في مستويات p الفرعية. المطويات 2. 11 3. ↑↑↑ 1. ↑ 4. ↑↓ ↑↑ ماذا قرأت؟ اذكر نص القوانين الثلاثة التي تعرّف كيفية ترتيب الإلكترونات في الذرات. 89 وزارون عليم Ministry of Education 2024-1446

أصل كلمة أوفباو
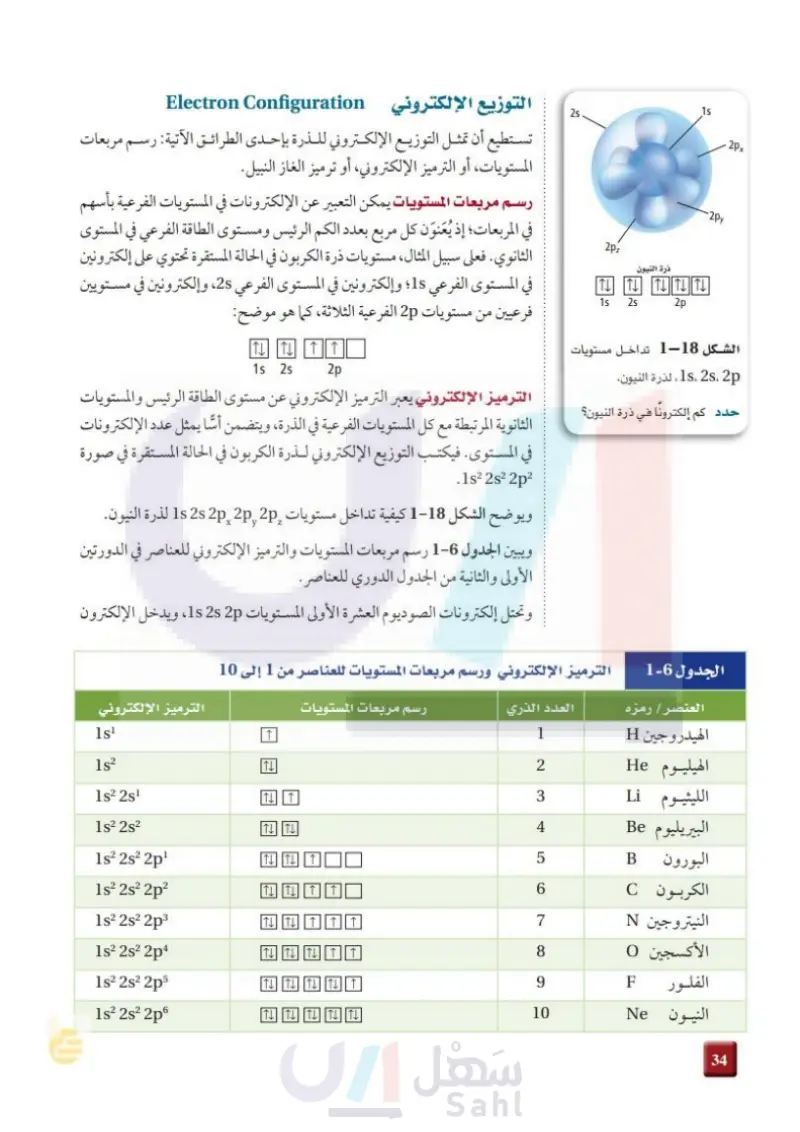
. 2px - 2py 15 ذرة النيون 2pz IT TITLITT 15 25 2p الشكل 218 تداخل مستويات 2s، 2p ، 15 ، لذرة النيون. حدد كم إلكترونا في ذرة النيون؟ 25 التوزيع الإلكتروني Electron Configuration تستطيع أن تمثل التوزيع الإلكتروني للذرة بإحدى الطرائق الآتية: رسم مربعات المستويات، أو الترميز الإلكتروني، أو ترميز الغاز النبيل. رسم مربعات المستويات يمكن التعبير عن الإلكترونات في المستويات الفرعية بأسهم في المربعات؛ إذ يُعنون كل مربع بعدد الكم الرئيس ومستوى الطاقة الفرعي في المستوى الثانوي. فعلى سبيل المثال، مستويات ذرة الكربون في الحالة المستقرة تحتوي على إلكترونين في المستوى الفرعي 1 وإلكترونين في المستوى الفرعي 2s ، وإلكترونين في مستويين فرعيين من مستويات 2p الفرعية الثلاثة، كما هو موم وضح: 15 25 2p الترميز الإلكتروني يعبر الترميز الإلكتروني عن مستوى الطاقة الرئيس والمستويات الثانوية المرتبطة مع كل المستويات الفرعية في الذرة، ويتضمن أسا يمثل عدد الإلكترونات في المستوى. فيكتب التوزيع الإلكتروني لذرة الكربون في الحالة المستقرة في صورة .1s² 2s² 2p² Z X ويوضح الشكل 2018 كيفية تداخل مستويات 2 2 2 2 1s لذرة النيون. ويبين الجدول - رسم مربعات المستويات والترميز الإلكتروني للعناصر في الدورتين الأولى والثانية من الجدول الدوري للعناصر . وتحتل إلكترونات الصوديوم العشرة الأولى المستويات 1s 2s 2p، ويدخل الإلكترون الجدول 6-2 الترميز الإلكتروني ورسم مربعات المستويات للعناصر من 1 إلى 10 العنصر / رمزه العدد الذري رسم مربعات المستويات الترميز الإلكتروني الهيدروجين H الهيليوم He الليثيوم Li 1 2 3 البيريليوم Be الله البورون LO الكربون النيتروجين N الأكسجين 0 الفلور النيون isl ↑ 1s2 ITI 152 251 ↑ 1s2 252 T T 4 1s2 2s2 2p TITI ↑ 5 B 1s2 2s2 2p2 6 C 1s2 2s2 2p3 TL TT 7 1s2 2s2 2p4 TL TTL TT 8 1s2 2s2 2p5 TL TTL TT 9 F 1s2 2s2 2p6 TL TTL TT 10 Ne 90 وزارة التعليم Ministry of Education 2024-1446

الحادي عشر المستوى 35 اعتمادًا على مبدأ أو فباو. لذا يكون الترميز الإلكتروني ورسم مربعات المستويات للصوديوم على النحو الآتي: 1s²2s²2p63s¹ 11 ↑ 1s 25 2p 3s المفردات ترميز الغاز النبيل ( الطريقة المختصرة) طريقة لتمثيل التوزيع الإلكتروني للغازات النبيلة الموجودة في العمود الأخير من الجدول الدوري، ويحتوي مدارها الأخير الاستخدام العلمي مقابل (ما عدا الهيليوم على ثمانية إلكترونات، وهي عادة مستقرة. وتستخدم الأقواس المربعة الاستخدام الشائع في ترميز الغاز النبيل. الدورة من هناك سبع دورات في الجدول الدوري فعلى سبيل المثال، [He] يمثل التوزيع الإلكتروني للهيليوم 1s، و [Ne] يمثل التوزيع الاستخدام العلمي: صفّ أفقي العناصر في الجدول الدوري الحديث. الإلكتروني للنيون 1s2222. قارن بين التوزيع الإلكتروني للنيون والصوديوم أعلاه. ولاحظ أن التوزيع الإلكتروني للمستويات الداخلية للصوديوم مماثل للتوزيع الحديث للعناصر. الإلكتروني للنيون. ويمكن أن تختصر التوزيع الإلكتروني للصوديوم باستخدام ترميز الاستخدام الشائع: فترة من الوقت الغاز النبيل على النحو الآتي .. ويوضح الجدول - التوزيع الإلكتروني محددة بواسطة ظاهرة متكررة. لعناصر الدورة الثالثة بطريقتي الترميز الإلكتروني، وترميز الغاز النبيل. تستغرق دورة الأرض حول الشمس ماذا قرأت ؟ وضح كيف يُكتب ترميز الغاز النبيل لعنصر ما ؟ وما ترميز الغاز سنة واحدة. النبيل للكالسيوم؟ الجدول 7-2 التوزيع الإلكتروني للعناصر من 11 إلى 18 العنصر/ رمزه العدد الذري طريقة الترميز الإلكتروني طريقة ترميز الغاز النبيل ( الطريقة المختصرة) الصوديوم Na الماغنسيوم M8 الألومنيوم السليكون Si الفوسفور الكبريت الكلور الأرجون Ar 1s² 2s² 2p63s¹ 11 [Ne]32 1s² 2s² 2p63s² 12 [Ne] 3s² 3p¹ 1s² 2s² 2p63s² 3p¹ 13 Al [Ne] 3s² 3p² 1s² 2s² 2p6 3s² 3p² 14 [Ne] 3s23p3 1s² 2s² 2p6 3s² 3p³ 15 P 1s² 2s² 2p6 3s² 3p4 16 S 1s22s2 2p6 3s2 3p5 17 CI 1s² 2s² 2p63s² 3p6 18 [Ne] 3s [Ne] 3s² 3p4 [Ne] 3s² 3p5 [Ar] أو Ne] 3s2 3p] 91 وارفت عليم Ministry of Education 2024-1446

الاستخدام العلمي مقابل الاستخدام الشائع الدورة
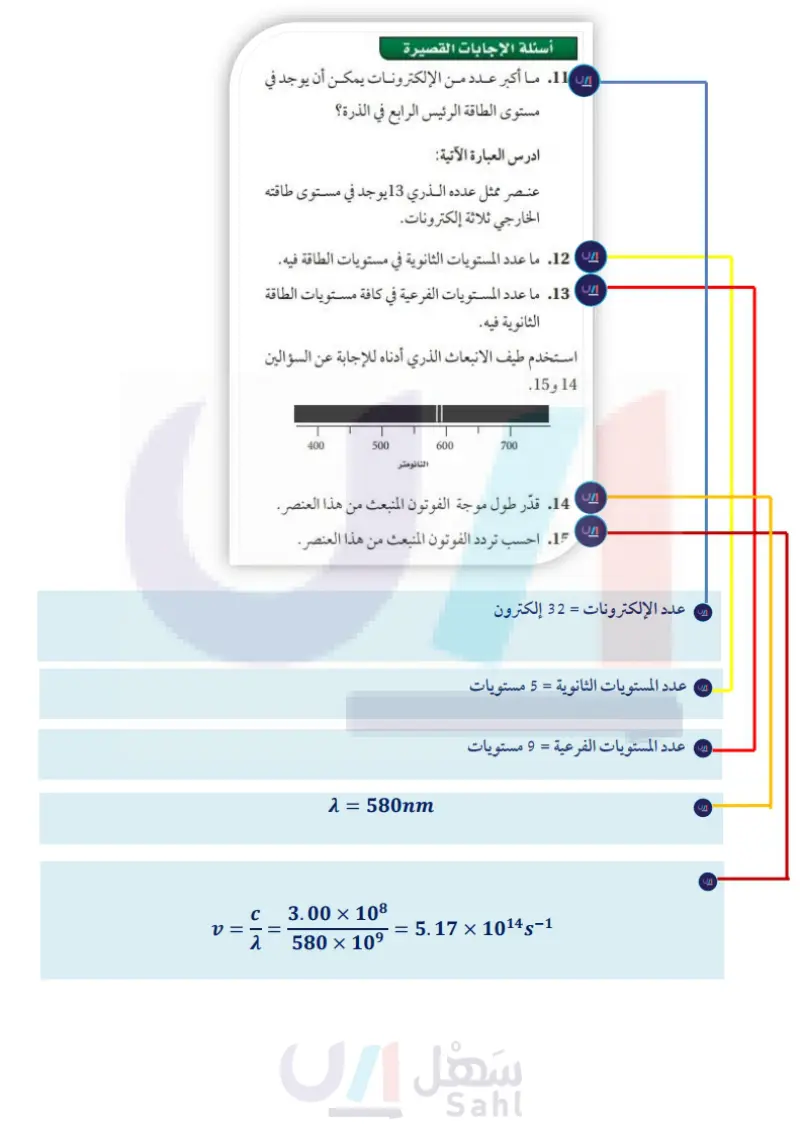
استثناءات التوزيع الإلكتروني يمكن استخدام رسم أو فباو في كتابة التوزيع الإلكتروني الأكثر استقرارًا للعناصر التي تبدأ من الفاناديوم ذي العدد الذري 23 وما بعده. ولكن إذا استمرت في توزيع الإلكترونات بالطريقة نفسها فإن التوزيع الإلكتروني للكروم سيكون Ar] 4s 3d] وللنحاس سيكون Ar] s2 3d] وهما غير صحيحتين. أما التوزيع الإلكتروني الصحيح للكروم ar] 4s 3d]، وللنحاس 10 Ars]. وتوضح التوزيعات الإلكترونية لهذين العنصرين – كما هو الحال لعناصر أخرى - حالة الاستقرار للمستويات نصف الممتلئة والممتلئة d و s. استراتيجية حل المسألة ملء مستويات الطاقة تستطيع أن تكتب التوزيع الإلكتروني للحالة المستقرة لأي عنصر كيميائي باستخدام رسم المستويات الثانوية واتباع الأسهم. 1 ارسم شكل المستويات الثانوية على ورقة بيضاء. 2 حدّد عدد إلكترونات ذرة واحدة من العنصر الذي تريد كتابة توزيعه الإلكتروني، علماً بأن عدد الإلكترونات في الذرة المتعادلة يساوي العدد الذري للعنصر. 3. ابدأ بالمستوى ،1s، واتبع تسلسل أو فباو للمستويات، وفي أثناء تقدمك أضف الأسس التي تشير إلى عدد الإلكترونات في كل مستوى، واستمر في ذلك حتى يكون لديك مستويات كافية لاستيعاب العدد الكلي من الإلكترونات في ذرة العنصر. 4. طبق ترميز الغاز النبيل. طبق الاستراتيجية اكتب التوزيع الإلكتروني في الحالة المستقرة للزركونيوم ZI. مسائل تدريبية 21. اكتب التوزيع الإلكتروني في الحالة المستقرة للعناصر الآتية: شمه 15 25 35 3p 3d 5 4s 4p 4d 4f 55 5p 5d 5f 65 бр 6d 7s 7p ترتيب ملء المستويات بالإلكترونات a. البروم Br b. الإسترانشيوم Sr C. الأنتيمون Sb d. الرينيوم Re e. التيربيوم Tb f. التيتانيوم Ti 22. تحتوي ذرة الكلور في الحالة المستقرة على سبعة إلكترونات في المستويات الفرعية لمستوى الطاقة الرئيس الثالث. ما عدد الإلكترونات التي تشغل مستويات p الفرعية من إلكترونات التكافو السبعة ؟ وما عدد الإلكترونات التي تشغل مستويات p من الإلكترونات السبعة عشر الأصلية الموجودة في ذرة الكلور؟ هي 23. عندما تتفاعل ذرة كبريت مع ذرات أخرى فإن إلكترونات مستوى الطاقة الثالث التي تشارك في التفاعل. ما عدد هذه الإلكترونات في ذرة الكبريت؟ .24 عنصر توزيعه الإلكتروني في الحالة المستقرة 5405 Kr]، وهو ينتمي إلى أشباه الموصلات، ويستخدم في صناعة سبائك عدة. ما هذا العنصر ؟ 25. تحفيز تحتوي ذرة عنصر في حالتها المستقرة إلكترونين في مستوى الطاقة الرئيس السادس. اكتب التوزيع الإلكتروني لهذا العنصر باستخدام ترميز الغاز النبيل، وحدد العنصر. 92 وزارة التعليم Ministry of Education 2024-1446

تحتوي ذرة عنصر في حالتها المستقرة إلكترونين في مستوى الطاقة الرئيس السادس ، اكتب التوزيع الإلكتروني لهذا العنصر باستخدام ترميز الغاز النيل ، وحدد العنصر .


عنصر توزيعه الإلكتروني في الحالة المستقرة Kr ] 5s²4d¹⁰5p ] ، وهو ينتمي إلى أشباه الموصلات ، ويستخدم في صناعة سبائك عدة . ما هذا العنصر ؟
![شرح عنصر توزيعه الإلكتروني في الحالة المستقرة Kr ] 5s²4d¹⁰5p ] ، وهو ينتمي إلى أشباه الموصلات ، ويستخدم في صناعة سبائك عدة . ما هذا العنصر ؟](https://sahl.io/img/main/play.png)
![حل عنصر توزيعه الإلكتروني في الحالة المستقرة Kr ] 5s²4d¹⁰5p ] ، وهو ينتمي إلى أشباه الموصلات ، ويستخدم في صناعة سبائك عدة . ما هذا العنصر ؟](https://sahl.io/img/main/pdf.png)
إلكترونات التكافؤ Valence Electrons تحدد إلكترونات التكافؤ ، الخواص الكيميائية للعنصر. وتعرف إلكترونات التكافؤ بأنها إلكترونات المستوى الخارجي للذرة ( مستوى الطاقة الرئيس الأخير). فعلى سبيل المثال، تحتوي ذرة الكبريت على 16 إلكترونا، ستة منها فقط تحتل مستويات 35 و 3 الخارجية، وهي إلكترونات التكافؤ، كما هو موضح في التوزيع الإلكتروني الآتي: S: [Ne] 3s2 3p4 وعلى الرغم من أن لذرة السيزيوم 55 إلكتروناً فإن لها إلكترون تكافؤ واحدا، في المستوى 6s، كما هو موضح في التوزيع الإلكتروني الآتي: وس Cs: [Xe] 6s¹ التمثيل النقطي للإلكترونات تمثيل لويس) يمثل الكيميائيون عادة إلكترونات التكافؤ التي تشارك في تكوين الروابط الكيميائية باستخدام طريقة مختصرة، تسمى التمثيل النقطي للإلكترونات، وفيها يكتب رمز العنصر الذي يمثل نواة الذرة ومستويات الطاقة الداخلية، محاطا بنقاط تُمثل إلكترونات المستوى الخارجي جميعها. وقد اقترح الكيميائي الأمريكي لويس Lewis (1875 - 1946م) هذه الطريقة عندما كان يدرّس مادة الكيمياء في الجامعة عام 1902م. وعند كتابة التمثيل النقطي للإلكترونات تُمثل النقاط إلكترونات التكافؤ وتوضع نقطة واحدة في كل مرة على الجوانب الأربعة للرمز (دون مراعاة التسلسل)، ثم تكرر هذه العملية لتصبح النقاط في صورة أزواج حتى تُستخدم النقاط جميعها. يوضح الجدول - التوزيع الإلكتروني لعناصر الدورة الثانية في الحالة المستقرة بطريقتي الترميز الإلكتروني والتمثيل النقطي للإلكترونات (تمثيل لويس). 2- الجدول 8-2 الترميز الإلكتروني والتمثيل النقطي للإلكترونات العنصر / رمزه الليثيوم البيريليوم البورون الكربون النيتروجين الأكسجين الفلور النيون العدد الذري الترميز الإلكتروني التمثيل النقطي للإلكترونات Li. 152 251 .Be. 1s2 252 3 4 Li الله Be .. 1s² 2s² 2p¹ LO 5 B .C. 1s² 2s² 2p² 6 C .. 1s2 2s2 2p3 7 N :0. 1s2 2s2 2p4 80 1s² 2s² 2p5 9 F :Ne: 1s² 2s² 2p6 10 Ne ... 93 ونافس عليم Ministry of Education 2024-1446

مثال 3-2 التمثيل النقطي للإلكترونات تحتوي بعض معاجين الأسنان على فلوريد القصديروز ، وهو مركب من القصدير والفلور. ما التمثيل النقطي لإلكترونات القصدير Sn؟ 1 تحليل المسألة بالرجوع إلى الجدول الدوري للعناصر ، حدّد العدد الذري لعنصر القصدير، واكتب توزيعه الإلكتروني، وحدد عدد إلكترونات تكافئه، ثم استخدم قواعد التمثيل النقطي للإلكترونات لرسم التمثيل النقطي الإلكتروني له (تمثيل لويس). 2 حساب المطلوب اكتب التوزيع الإلكتروني للقصدير باستخدام ترميز الغاز النبيل. أقرب غاز نبيل هو الكريبتون Kr العدد الذري للقصدير 50 ، لذا تحتوي ذرة القصدير على 50 إلكتروناً. [Kr]5s24d105p² تمثل إلكترونات 52 و 5p2 إلكترونات التكافؤ الأربعة للقصدير. ارسم أربعة إلكترونات حول رمز القصدير الكيميائي Sn لتوضيح التمثيل النقطي الإلكتروني للقصدير ؟؟ . 3 تقويم الإجابة تم استخدام الرمز الصحيح للقصدير n وقواعد التمثيل النقطي للإلكترونات بصورة صحيحة. مسائل تدريبية .26 ارسم التمثيل النقطي لإلكترونات العناصر الآتية: a. الماغنسيوم Mg b. الثاليوم T1 c. الزينون Xe .27. تحتوي ذرة عنصر على 13 إلكترونًا. ما هذا العنصر ؟ وكم إلكتروناً يظهر في التمثيل النقطي للإلكترونات؟ 28. تحفيز يحتمل أن يكون عنصر في الحالة الغازية عند درجة حرارة الغرفة والضغط الجوي العادي أحد العناصر الآتية: الهيدروجين، أو الهيليوم، أو النيتروجين أو الأكسجين، أو الفلور، أو الكلور ، أو النيون. ما هذا العنصر إذا علمت أن التمثيل النقطي الإلكتروني له ۰۰؟ التقويم 3-2 الخلاصة يُسمى ترتيب الإلكترونات في الذرة التوزيع الإلكتروني للذرة. 29. الفكرة الرئيسة طبق مبدأ باولي، ومبدأ أو فباو، وقاعدة هـونـــد، لكتابة التوزيع الإلكتروني لكل من العناصر الآتية: a السليكون b Si. الفلور . . . الكالسيوم d Car. الكربتون Kr. يُحدّد التوزيع الإلكتروني للذرة بمبدأ 30. عرّف إلكترونات التكافؤ . أو فباو، ومبدأ باولي، وقاعدة هوند. 31. ارسم تسلسل ملء المستويات الفرعية الخمسة للمستوى الثانوي d بعشرة تحدد إلكترونات تكافؤ العنصر خواصه الكيميائية. إلكترونات. 32. التوسع عنصر لم يعرف بعد ولكن إلكتروناته تملأ المستويات الفرعية يمكن تمثيل التوزيع الإلكتروني باستخدام للمستوى الثانوي .7p . ما عدد إلكترونات ذرة هذا العنصر ؟ اكتب توزيعه رسم مربعات المستويات والترميز الإلكتروني باستخدام ترميز الغاز النبيل. الإلكتروني، وترميز الغاز النبيل. 33. تفسير الرسوم العلمية ما التمثيل النقطي لإلكترونات ذرة السيلينيوم؟ فسّر إجابتك. وزارة التعليم Ministry of Education 2024-1446 ...d ·Se.. .C • Se· .b Se: a 94

تحتوي بعض معاجين الأسنان على فلوريد القصدير وهو مركب من القصدير والفلور ما التمثيل النقطي لإلكترونيات القصدير Sn؟

التوسع عنصر لم يعرف بعـد ولـكـن إلكتروناتـه تمـلأ المستويات الفرعية للمستوى الثانـوي 7p ، ما عدد إلكترونات ذرة هـذا العنصر ؟ اكتب توزيعه الإلكتروني باستخدام ترميز الغاز النبيل .


الكيمياء والصحة ملاقط الليزر يستطيع العلماء الإمساك بخلية واحدة باستعمال ملاقط تختلف عن المتعارف عليها؛ إذ تتكون هذه الملاقط من حزمتي ليزر يمكنها التقاط الأشياء الصغيرة جدا، ومنها الخلايا والذرات المفردة. ولعلك سمعت عن استخدام الليزر في قطع الأشياء؛ إذ تستخدم مقصات الليزر في بعض العمليات الجراحية. ولكن من المثير للدهشة أن الليزر يمكنه الإمساك بالخلايا الحية والأجسام الصغيرة دون إتلافها. فكيف تتمكن حزم الضوء من تثبيت الأشياء في أماكنها؟ ملقط ليزر خيوط مغزلية كروموسوم عدسات مقص ملقط ليزر . خلية الشكل 2 تستطيع أشعة الليزر الأصغر اختراق العضيات الموجودة داخل الخلايا الحية الإمساك باستخدام الضوء عند مرور الأشعة الضوئية من خلال الليزر والسرطان أين يستخدم العلماء هذه الملاقط الصغيرة؟ خلية ما فإنها تغير من اتجاهها قليلا، وهذا مشابه لكيفية انحناء تقوم مجموعة من العلماء باستخدامها لدراسة عضيات الخلية أشعة الضوء عند مرورها بوسط مائي، كحوض السمك مثلاً . الصغيرة. فهم يدرسون القوى التي تبذلها الخيوط المغزلية وتجمع الأنيبيبات الدقيقة التي تنسق انقسام الخلية. فترشد هذه الخيوط وعندما تنحني أشعة الضوء تبذل قوة صغيرة جدا لا تؤثر في الأجسام الكبيرة مثل حوض السمك، ولكن الخلايا الصغيرة تجيب لهذه القوة. وإذا تم توجيه أشعة الضوء في الاتجاه الصحيح أمكنها عندئذ تثبيت جسم صغير في مكانه، كما في الشكل 1. شعاع 2 1 2 عدسة مجهر شعاع ليزر F₁ F خلية 1 2 شعاع 1 الشكل 1 تنحني الحزمة الضوئية في أثناء مرور أشعة الليزر من خلال الخلية، وتبذل الحزمة قوة صغيرة على الخلية تعمل في الاتجاه المعاكس وتثبت هذه القوة الخلية في مكانها. من المغزلية الكروموسومات المنسوخة إلى الجوانب المتعاكسة الخلية، وهو دور رئيس في انقسام الخلية. وعلى أي حال لا يعرف العلماء تمامًا كيف تقوم هذه الخيوط المغزلية بوظيفتها. استخدمت مقصات الليزر الصغيرة لقطع أجزاء من الكروموسومات خلال عملية انقسام الخلايا. واستخدمت ملاقط الليزر بعد ذلك لتحريك القطع داخل الخلية وحول الخيوط المغزلية، كما في الشكل .2 . وبمعرفة القوة التي تمسك بها الملاقط الكروموسومات يستطيع العلماء قياس القوة المقابلة التي تبذلها الخيوط المغزلية. ويأمل العلماء أن يعرفوا كيف تعمل الخيوط المغزلية خلال عملية انقسام الخلية، مما يساعدهم على معرفة الأمراض المرتبطة مع انقسام الخلية، ومنها السرطان الذي تنقسم فيه الخلايا بصورة غير قابلة للتحكم. الكتابة في الكيمياء أشعة الليزر يستخدم الليزر في أنواع متعددة من الأجهزة المستعملة في الحياة اليومية. ابحث عن الأنواع المختلفة من الليزر التي نستخدمها في حياتنا، وتعرف نوع الضوء الذي يستخدمه كل جهاز . ثم لخص نتائج البحث في دفتر العلوم. 95 وارفت عليم Ministry of Education 2024-1446

2 دليل مراجعة الفصل 23 الفكرة العامة الإلكترونات ذرات كل عنصر ترتيب خاص. 2-1 الضوء وطاقة الكم الفكرة الرئيسة للضوء - وهو نوع من الإشعاع المفاهيم الرئيسة الكهرومغناطيسي - طبيعة ثنائية موجية وجسيمية. • تعرّف الموجات بأطوالها الموجية وتردداتها و سعاتها وسرعاتها. المفردات الإشعاع الكهرومغناطيسي • ثابت بلانك الطول الموجي • التأثير الكهروضوئي . التردد . الفوتون سعة الموجة • طيف الانبعاث الذري سرعة الموجة الطيف الكهرومغناطيسي c = λ f تنتقل الموجات الكهرومغناطيسية في الفراغ بسرعة الضوء للموجات الكهرومغناطيسية صفات كل من الموجة والجسيم. • تمتص المادة الطاقة وتبعثها بمقدار يُعرف بالكم. = hf الكم E ينتج الضوء الأبيض طيفًا متصلاً، في حين يتألف طيف الانبعاث للعنصر من سلسلة خطوط ملونة ومنفصلة. الكم 2-2- نظريَّةُ الكم والدَّرَّة الفكرة الرئيسة تساعدك الخصائص الموجية المفاهيم الرئيسة للإلكترونات على الربط بين طيف الانبعاث الذري • يربط نموذج بور للذرة طيف انبعاث الهيدروجين بانتقال الإلكترونات وطاقة الذرة ومستويات الطاقة. المفردات . حالة الاستقرار . المستوى من مستويات طاقة عليا إلى مستويات طاقة منخفضة. تربط معادلة دي برولي طول موجة الجسيم مع كتلتها وسرعتها وثابت بلانك. العدد الكمي الرئيس الطاقة الثانوي . حالة الإثارة العدد الكمي • مستوى الطاقة الرئيس مبدأ الشك لهايزنبرج مستوى النموذج الميكانيكي الكمي للذرة λ=h/mv • يفترض النموذج الميكانيكي الكمي للذرة أن للإلكترونات خواص موجية. • تحتل الإلكترونات مناطق ثلاثية الأبعاد تُسمى المستويات الفرعية. 3- التوزيع الإلكتروني الفكرة الرئيسة يحدّد التوزيع الإلكتروني في الذرة المفاهيم الرئيسة باستخدام ثلاث قواعد. المفردات التوزيع الإلكتروني مبدأ باولي مبدأ أوفباو . قاعدة هوند إلكترونات التكافؤ يُسمّى ترتيب الإلكترونات في الذرة التوزيع الإلكتروني للذرة. يحدّد التوزيع الإلكتروني بالاعتماد على مبدأ أو فباو، ومبدأ باولي، وقاعدة هوند. تحدّد إلكترونات التكافؤ الخواص الكيميائية للعنصر. يمكن تمثيل التوزيع الإلكتروني باستخدام رسم مربعات المستويات، التمثيل النقطي للإلكترونات ( تمثيل لويس) والترميز الإلكتروني، وترميز الغاز النبيل. 96 وزارة التعليم Ministry of Education 2024-1446

لإلكترونات ذرات كل عنصر ترتيب خاص
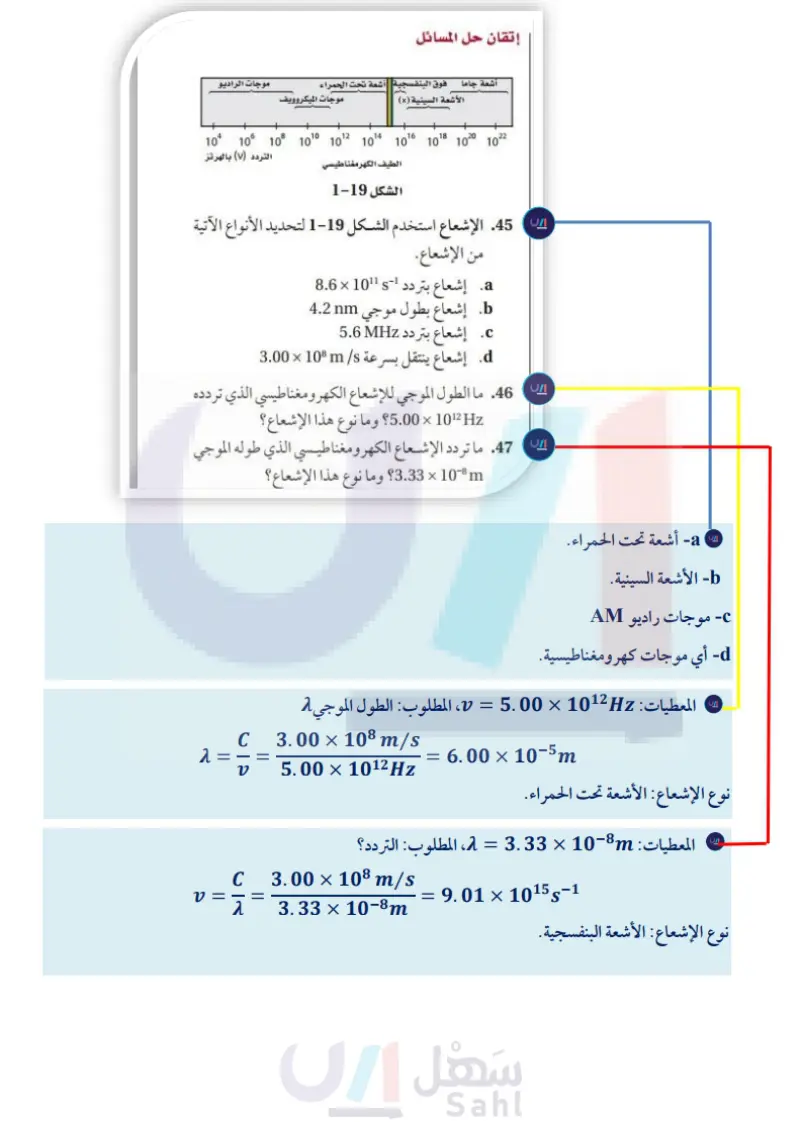
2 التقويم 21 الفصل 2-1 إتقان المفاهيم 34. عرّف المصطلحات الآتية: a. التردد .C الكم b. الطول الموجي d. الحالة المستقرة إتقان حل المسائل أشعة جاما فوق البنفسجية أشعة تحت الحمراء الأشعة السينية (x) موجات الميكروويف + موجات الراديو 106 108 1010 1012 1014 1016 1018 10 20 10 22 الطيف الكهرمغناطيسي 104 التردد (f) بالهرتز الشكل 19-2 35. رتب الأنواع الآتية من الإشعاعات الكهرومغناطيسية 45. الإشعاع استخدم الشكل 1-2 لتحديد الأنواع الآتية تصاعديا حسب الطول الموجي .a. الضوء فوق البنفسجي . موجات الراديو b. الميكروويف d. الأشعة السينية من الإشعاع. a إشعاع بتردد 51 101 × 8.6 . إشعاع بطول موجي 4.2nm إشعاع بتردد MHz 5.6 . 36. ما الذي تعنـيـه عـبـارة "أشـعـة جـامـا لـهـا تـردد d إشعاع ينتقل بسرعة m/s 10 × 3.00 Hz 21 10 × 2.88"؟ 37. ما المقصود بالتأثير الكهروضوئي؟ .46. ما الطول الموجي للإشعاع الكهرومغناطيسي الذي تردده 10Hz × 5.00؟ وما نوع هذا الإشعاع؟ 38. مصباح النيون كيف يختلف الضوء المنبعث من مصباح 47. ما تردد الإشعاع الكهرومغناطيسي الذي طوله الموجي m-10 × 3.33؟ وما نوع هذا الإشعاع؟ نيون عن ضوء الشمس؟ 48. ما سرعة الموجة الكهرومغناطيسية التي ترددها 39. وضح مفهوم بلانك للكم من حيث علاقته باكتساب Hz 10 1.33 وطول موجتها nm 2.25 ؟ المادة للطاقة أو فقدها. .40 كيف وضح أينشتاين التأثير الكهروضوئي؟ 41. قوس المطر اذكر فرقين بين الموجات الكهرومغناطيسية الحمراء والخضراء في قوس المطر. 42. درجة الحرارة ماذا يحدث للضوء المنبعث من جسم ساخن و مشع كلما ازدادت درجة حرارته؟ ء 49. ما طاقة فوتون من الضوء الأحمر تردده 10142 × 4.48؟ Hg X (nm) 400 450 500 550 600 650 700 الشكل 20-2 50 الزئبق يظهر في الشكل 2000 طيف الانبعاث الذري للزئبق. قدر الطول الموجي للخط البرتقالي. ما تردده؟ 43. اذكر ثلاث خصائص لم يستطع النموذج الموجي للضوء وما طاقة الفوتون لهذا الخط المنبعث من ذرة الزئبق ؟ تفسيرها، بسبب طبيعتها الجسيمية. .44 كيف تتشابه موجات الراديو والموجات فوق البنفسجية؟ وكيف تختلف؟ 51. ما طاقة الفوتون فوق البنفسجي الذي طول موجته 8m-10 × 1.18؟ 52. فوتون يمتلك طاقة مقدارها [ 25-10 × 2.93، فما تردده؟ وما نوع الإشعاع الكهرومغناطيسي لهذا الفوتون؟ 97 وارقاس عليم Ministry of Education 2024-1446

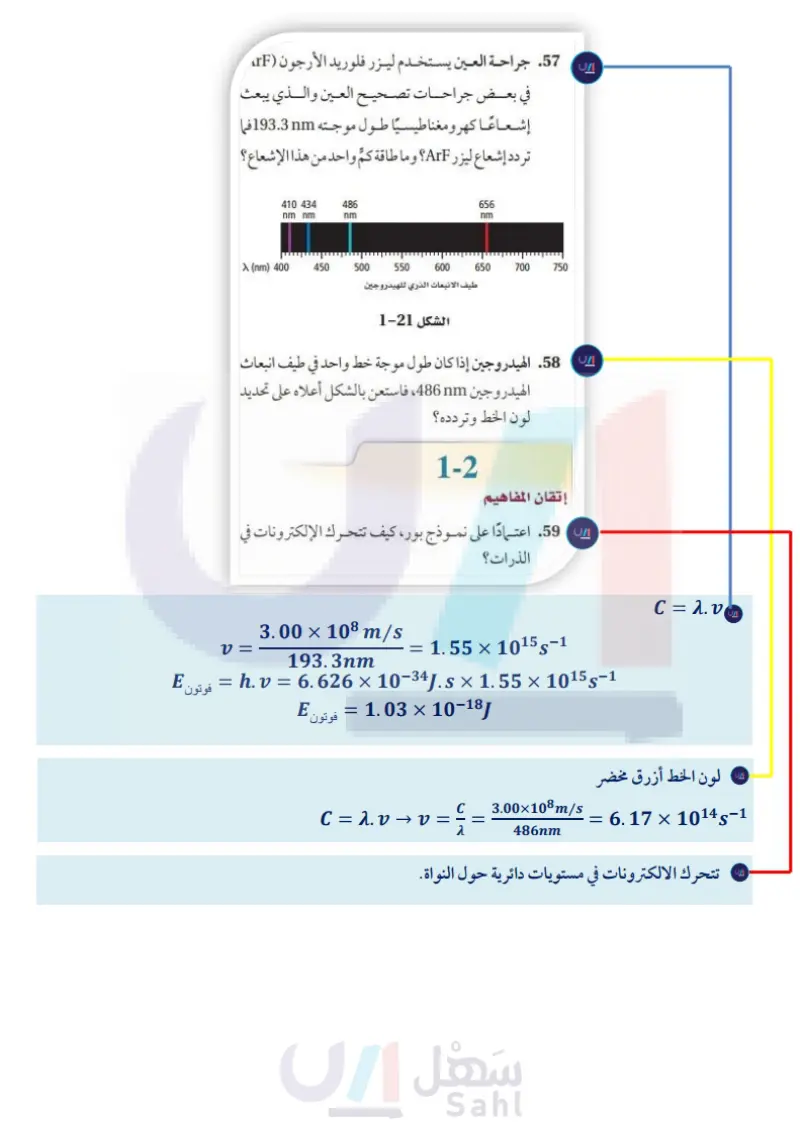
2 تقويم الفصل 53. فوتون يمتلك طاقة مقدارها [13- 10 × 1.10، فما طول 60. ما الذي تمثله n في نموذج بور الذري؟ موجته ؟ وما نوع الإشعاع الكهرومغناطيسي لهذا الفوتون؟ 61. ما الفرق بين حالة الاستقرار وحالة الإثارة للذرة؟ 54. السفينة الفضائية ما الوقت الذي تحتاج إليه إشارة الراديو 62. ما اسم النموذج الذري الذي تُعامل فيه الإلكترونات من سفينة الفضاء فويجر حتى تصل الأرض إذا كانت على أنها موجات؟ ومن أول من كتب معادلات موجة المسافة بين فويجر والأرض km 10 × 2.72؟ الإلكترون التي أدت إلى هذا النموذج ؟ ؟ 55. موجات الراديو إذا كانت محطة إذاعة FM تبث على 63. ما المقصود بالمستوى الفرعي تردد MHz 104.5 ، فما الطول الموجي لإشارة 64. ما الذي ترمز إليه n في النموذج الميكانيكي الكمي للذرة؟ 65. انتقال الإلكترون اعتمادًا على نموذج بور الموضح في الشكل المحطة بالأمتار ؟ وما طاقة الفوتون لهذه المحطة؟ .56 بلاتين ما أقل تردد للضوء الذي يتطلبه إرسال فوتو إلكترون 22- ما نوع انتقالات الإلكترون التي تنتج سلاسل فوق واحد من ذرات البلاتين والتي تحتاج على الأقل إلى ( 9.08 بنفسجية في سلسلة ليمان لذرة الهيدروجين؟ J /photon 19- 10 ×) ؟ 57. جراحة العين يستخدم ليزر فلوريد الأرجون (ArF) سلاسل الضوء المرئي (بالمر) n=4 n=5 n = 6 n=7 n=3 في بعض جراحات تصحيح العين والذي يبعث إشعاعا كهرومغناطيسيًا طول موجته 193.3nm فا السلاسل تحت الحمراء (باشن) تردد إشعاع ليزر ArF؟ وما طاقة كم واحد من هذا الإشعاع ؟ 656 nm 650 700 750 600 550 طيف الانبعاث الذري للهيدروجين الشكل 21-2 410 434 nm nm 486 nm > (nm) 400 450 500 السلاسل فوق البنفسجية (ليمان) الشكل 22-2 66. ما عدد مستويات الطاقة الثانوية في المستويات الثلاثة الرئيسة الأولى للطاقة في ذرة الهيدروجين؟ 67. ما عدد المستويات الفرعية في المستوى الثانوي d؟ 68. ما وجه التشابه بين مستويات الطاقة الفرعية في مستوى الطاقة الثانوي؟ 58. الهيدروجين إذا كان طول موجة خط واحد في طيف انبعاث 69. ما اتجاهات المستويات الفرعية الخمسة المرتبطة في المستوى الهيدروجين 486nm، فاستعن بالشكل أعلاه على تحديد لون الخط وتردده؟ إتقان المفاهيم 2-2 الثانوي d؟ 70. ما أقصى عدد يمكن أن يسعه المستوى الفرعي من الإلكترونات؟ 71. صف الاتجاهات النسبية للمستويات الفرعية المرتبطة في المستوى الثانوي 2p. 72. ما عدد الإلكترونات التي يمكن أن توجد في جميع 59. اعتمادًا على نموذج ،بور كيف تتحرك الإلكترونات في المستويات الفرعية للمستوى الرئيس الثالث للطاقة في الذرات؟ ذرة الأرجون؟ وزارة التعليم Ministry of Education 2024-1446 98

يستخدم ليزر فلوريد الأرجون في بعض جراحات تصحيح العين والذي يبعث إشعاعا كهرومغناطيسي طول موجته 193.3nm فما تردد إشعاع ليزر ArE؟ وما طاقة كم واحد من هذا الإشعاع؟

السفينة الفضائية ما الوقت الذي تحتاج إليه إشارة الراديو من سفينة الفضـاء فويجر حتى تصل الأرض إذا كانت المسافة بين فويجر والأرض 2.72×10⁹km

إذا كانت محطة إذاعة FM تبث على تردد 104.5MHz فما الطول الموجي لإشارة المحطة بالأمتار؟ وما طاقة الفوتون لهذه المحطة؟

إذا كان طول موجة خط واحد في طيف انبعاث الهيدروجين 486nm فاستعن بالشكل أعلاه على تحديد لون الخط وتردده؟

تقويم الفصل 2 73. كيف يصف النموذج الميكانيكي الكمي مسار الإلكترونات 80. ما عدد الإلكترونات التي تظهر في التمثيل النقطي في الذرة؟ للإلكترونات لذرات العناصر الآتية؟ 74. لماذا يكون من المستحيل لنا أن نعرف بدقة سرعة الإلكترون a الكربون وموقعه في الوقت نفسه؟ .C الكالسيوم d. الجاليوم إتقان المفاهيم 2-3 b اليود 81. ما المبادئ الثلاثة أو القواعد التي يجب اتباعها عند كتابة التوزيع الإلكتروني لذرة عنصر ما ؟ 82. اكتب التوزيع الإلكتروني لذرات الأكسجين والكبريت، 75. ما تسلسل ملء الإلكترونات في المستويات الفرعية بطريقة الترميز الإلكتروني. للمستوى الثانوي؟ إتقان حل المسائل: استعن بالجدول الدوري 76. الروبيديوم وضح باستخدام الشكل 23-2، لماذا يشغل عند الحاجة للحصول على الأعداد الذرية للعناصر) إلكترون واحد في ذرة الروبيديوم مستوى 5s بدلاً من اكتب تسلسل أوفباو للمستويات من 1s إلى 7p . 4d أو 4f؟ 7p 6d 5f S 75 бр 5d 4f SS 5p 4d 55 4p 3d 45 4s 3p 35 2p 25 15 تسلسل ملء المجالات ازدياد الطاقة 83. اكتب التوزيع الإلكتروني للعناصر الآتية بطريقتي الترميز الإلكتروني ورسم مربعات المستويات: a البيريليوم c النيتروجين b. الألومنيوم d الصوديوم 84. استخدم ترميز الغاز النبيل لكتابة التوزيع الإلكتروني للعناصر الآتية: Zr a Pb .b Kr.c P.d الشكل 23-2 77. ما إلكترونات التكافؤ ؟ وكم إلكترون تكافؤ في ذرة الماغنسيوم من الإلكترونات الاثني عشر التي تحتويها؟ 78. إن للضوء طبيعة مزدوجة (موجة – جسيم). فماذا تعني هذه الحملة؟ 79. صف الفرق بين الكم والفوتون. 85. حدد العنصر الذي يُمثل بالتوزيع الإلكتروني الآتي: 1s2 2s2 2p5 a [Ar] 4s² .b [Xe] 6s 4f4 [Kr] 5s² 4d10 5p4 .d 1s2 2s2 2p6 3s2 3p6 4s² 3d10 4p5 .f [Rn] 7s² 5f13 .e 99 وزارون عليم Ministry of Education 2024-1446

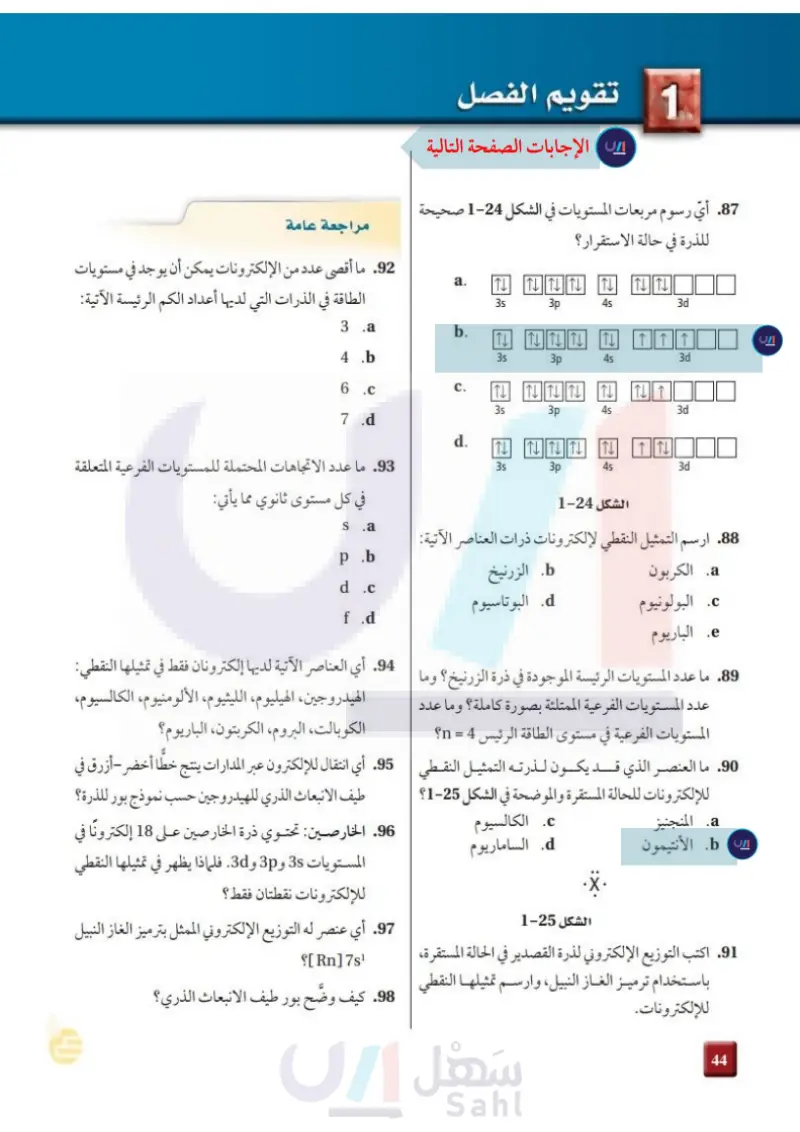
2 تقويم الفصل 86. أي رسوم مربعات المستويات في الشكل 24-2 صحيحة للذرة في حالة الاستقرار ؟ مراجعة عامة 91. ما أقصى عدد من الإلكترونات يمكن أن يوجد في مستويات الطاقة في الذرات التي لديها أعداد الكم الرئيسة الآتية: a. T TITL 35 3p 4s 3d 3.a b. TN TL TTL TI ↑↑↑ 4.b 35 3p 4s 3d 6 .c C. Th IT TITL ITI TIT 35 3p 4s 3d 7.d d. T1 T 35 3p 4s 3d الشكل 24-2 87 ارسم التمثيل النقطي لإلكترونات ذرات العناصر الآتية: b. الزرنيخ 92. ما عدد الاتجاهات المحتملة للمستويات الفرعية المتعلقة في كل مستوى ثانوي مما يأتي: s.a p.b a الكربون البولونيوم d. البوتاسيوم . الباريوم d.c f.d 93. أي العناصر الآتية لديها إلكترونان فقط في تمثيلها النقطي 88. ما عدد المستويات الرئيسة الموجودة في ذرة الزرنيخ؟ وما عدد المستويات الفرعية الممتلئة بصورة كاملة؟ وما عدد الهيدروجين، الهيليوم، الليثيوم، الألومنيوم، المستويات الفرعية في مستوى الطاقة الرئيس 4 = n؟ الكوبالت البروم، الكربتون، الباريوم؟ الكالسيوم، 89. ما العنصر الذي قد يكون لذرته التمثيل النقطي 94. أي انتقال للإلكترون عبر المدارات ينتج خطًا أخضر - أزرق في للإلكترونات للحالة المستقرة والموضحة في الشكل 25-2 a المنجنيز b. الأنتيمون .C الكالسيوم d الساماريوم الشكل 25-2 طيف الانبعاث الذري للهيدروجين حسب نموذج بور للذرة؟ 95. الخارصين تحتوي ذرة الخارصين على 18 إلكترونا في المستويات 3 و 3p و 3d. فلماذا يظهر في تمثيلها النقطي للإلكترونات نقطتان فقط ؟ 96. أي عنصر له التوزيع الإلكتروني الممثل بترميز الغاز النبيل 90. اكتب التوزيع الإلكتروني لذرة القصدير في الحالة المستقرة، Rn] 7s ]؟ باستخدام ترميز الغاز النبيل وارسم تمثيلها النقطي 97. كيف وضّح بور طيف الانبعاث الذري؟ 100 للإلكترونات. وزارة التعليم Ministry of Education 2024-1446

ما أقصى عدد من الإلكترونات يمكن أن يوجد في مستويات الطاقة في الذرات التي لديها أعداد الكم الرئيسة الأتية 3

أي العناصر الآتية لديها إلكترونان فقط في تمثيلها النقطي الهيدروجين ، الهيليوم ، الليثيوم ، الألومنيوم ، الكالسيوم ، الكوبالت ، البروم ، الكربتون ، الباريوم ؟

تحتـوي ذرة الخارصين على 18 إلكترونا في المستويات 3s و 3 p و 3d . فلماذا يظهر في تمثيلها النقطي للإلكترونات نقطتان فقط ؟

اكتب التوزيع الإلكتروني لذرة القصدير في الحالة المستقرة باستخدام ترميز الغاز النبيل وارسم تمثيلها النقطي للإلكترونيات


تقويم الفصل 2 تقويم إضافي الكتابة في الكيمياء التفكير الناقد 98. صف أشكال المستويات الفرعية الموضحة في الشكل 2-26، وحدّد اتجاهاتها. X Z dxz py Z X Z المستوى الفرعي p المستوى الفرعي 15 102. لوحات النيون: لعمل لوحات نيــون تبعث ألوانًا مختلفة، يملأ المصنعون اللوحات بغازات غير النيون. اكتب مقالة تعبر فيها عن استخدام الغازات في لوحات النيون والألوان التي تنتجها تلك الغازات. 103 نموذج رذرفورد تخيل أنك عــــالم في أوائل القرن العشرين، وقد علمت بتفاصيل النموذج الذري الجديد المقترح من الفيزيائي البريطاني أرنست رذرفورد. بعد تحليلك لهذا النموذج وضح أهم نقاط الضعف التي تعتقد أنه يتضمنها، ثم اكتب رسالة المستوى الفرعي d الشكل 26-2 موجهة إلى رذرفورد تعبر فيها عن اهتمامك بنموذجه، 99. استنتج تخيل أنك تعيش في عالم ينص فيه مبدأ باولي على أن مستخدمًا رسومًا وأمثلة على عناصر محددة لمساعدتك ثلاثة إلكترونات على الأكثر، وليس اثنين، قد تكون في كل على إظهار وجهة نظرك. أسئلة المستندات مستوى طاقة فرعي اشرح الخواص الكيميائية الجديدة لعناصر الليثيوم والفوسفور. مراجعة تراكمية 100. حدد ما إذا كانت كل جملة تصف خاصية كيميائية أو خاصية فيزيائية. a الزئبق سائل عند درجة حرارة الغرفة. b السكروز صلب أبيض بلوري. يصدأ الحديد عندما يتعرض للهواء الرطب. d يحترق الورق عندما يشتعل . عند تبخر فلز الصوديوم في أنبوب التفريغ ينتج خطان متقاربان، أحدهما أصفر والأخر برتقالي. ولأن أنابيب بخار الصوديوم فعالة كهربائيًا فإنها تستخدم على نطاق واسع في الإضاءة خارج المنازل، كما في إنارة الشوارع، وأضواء (التحذير) الأمن. يبين الشكل 27-22 الطيف المرئي وطيف الانبعاث للصوديوم. الشكل 27-2 104. ما الفرق بين الطيفين في الشكل أعلاه ؟ 101. إذا كان العدد الذري لذرة الجادو لينيوم 64، وعددها 105. يشع الصوديوم خطين طولاهما 588.9590nm الكتلي 153 فما عدد كل من الإلكترونات والبروتونات و 589.9524nm على الترتيب . اكتب التوزيع الإلكتروني الأكثر استقرارًا للصوديوم. ما علاقة والنيوترونات التي توجد فيها؟ التوزيع الإلكتروني للصوديوم بالخطوط؟ 106. احسب طاقات الفوتونات المرتبطة بالخطين، مستخدمًا المعادلات: E=hc, c = E = hf 101 والتعليم Ministry of Education 2024-1446

لعمل لـوحـات نيون تبعـث ألوانا مختلفة ، يمـلا المصنعـون اللـوحـات بـغـازات غير النيون . اكتب مقالة تعبر فيها عن استخدام الغازات في لوحات النيون والألوان التي تنتجها تلك الغازات .
تخيل أنك تعيش في عالم ينص فيه مبدأ باولي على أن ثلاثة إلكترونات على الأكثر ، وليس اثنين ، قد تكون في كل مستوى طاقة فرعي . اشرح الخواص الكيميائية الجديدة لعناصر الليثيوم والفوسفور .

إذا كان العـدد الـذري لـذرة الجادولينيـوم 64 ، وعددها الكـتــي 153 فيها عدد كل مـن الإلكترونات والبروتونات والنيوترونات التي توجد فيها ؟

اكتب رسالة موجهة إلى رذرفورد تعبر فيها عن اهتمامك بنموذجه ، مستخدما رسوما وأمثلة على عناصر محددة لمساعدتك على إظهار وجهة نظرك .
تقويم الفصل 2 تقويم إضافي الكتابة في الكيمياء التفكير الناقد 98. صف أشكال المستويات الفرعية الموضحة في الشكل 2-26، وحدّد اتجاهاتها. X Z dxz py Z X Z المستوى الفرعي p المستوى الفرعي 15 102. لوحات النيون: لعمل لوحات نيــون تبعث ألوانًا مختلفة، يملأ المصنعون اللوحات بغازات غير النيون. اكتب مقالة تعبر فيها عن استخدام الغازات في لوحات النيون والألوان التي تنتجها تلك الغازات. 103 نموذج رذرفورد تخيل أنك عــــالم في أوائل القرن العشرين، وقد علمت بتفاصيل النموذج الذري الجديد المقترح من الفيزيائي البريطاني أرنست رذرفورد. بعد تحليلك لهذا النموذج وضح أهم نقاط الضعف التي تعتقد أنه يتضمنها، ثم اكتب رسالة المستوى الفرعي d الشكل 26-2 موجهة إلى رذرفورد تعبر فيها عن اهتمامك بنموذجه، 99. استنتج تخيل أنك تعيش في عالم ينص فيه مبدأ باولي على أن مستخدمًا رسومًا وأمثلة على عناصر محددة لمساعدتك ثلاثة إلكترونات على الأكثر، وليس اثنين، قد تكون في كل على إظهار وجهة نظرك. أسئلة المستندات مستوى طاقة فرعي اشرح الخواص الكيميائية الجديدة لعناصر الليثيوم والفوسفور. مراجعة تراكمية 100. حدد ما إذا كانت كل جملة تصف خاصية كيميائية أو خاصية فيزيائية. a الزئبق سائل عند درجة حرارة الغرفة. b السكروز صلب أبيض بلوري. يصدأ الحديد عندما يتعرض للهواء الرطب. d يحترق الورق عندما يشتعل . عند تبخر فلز الصوديوم في أنبوب التفريغ ينتج خطان متقاربان، أحدهما أصفر والأخر برتقالي. ولأن أنابيب بخار الصوديوم فعالة كهربائيًا فإنها تستخدم على نطاق واسع في الإضاءة خارج المنازل، كما في إنارة الشوارع، وأضواء (التحذير) الأمن. يبين الشكل 27-22 الطيف المرئي وطيف الانبعاث للصوديوم. الشكل 27-2 104. ما الفرق بين الطيفين في الشكل أعلاه ؟ 101. إذا كان العدد الذري لذرة الجادو لينيوم 64، وعددها 105. يشع الصوديوم خطين طولاهما 588.9590nm الكتلي 153 فما عدد كل من الإلكترونات والبروتونات و 589.9524nm على الترتيب . اكتب التوزيع الإلكتروني الأكثر استقرارًا للصوديوم. ما علاقة والنيوترونات التي توجد فيها؟ التوزيع الإلكتروني للصوديوم بالخطوط؟ 106. احسب طاقات الفوتونات المرتبطة بالخطين، مستخدمًا المعادلات: E=hc, c = E = hf 101 والتعليم Ministry of Education 2024-1446

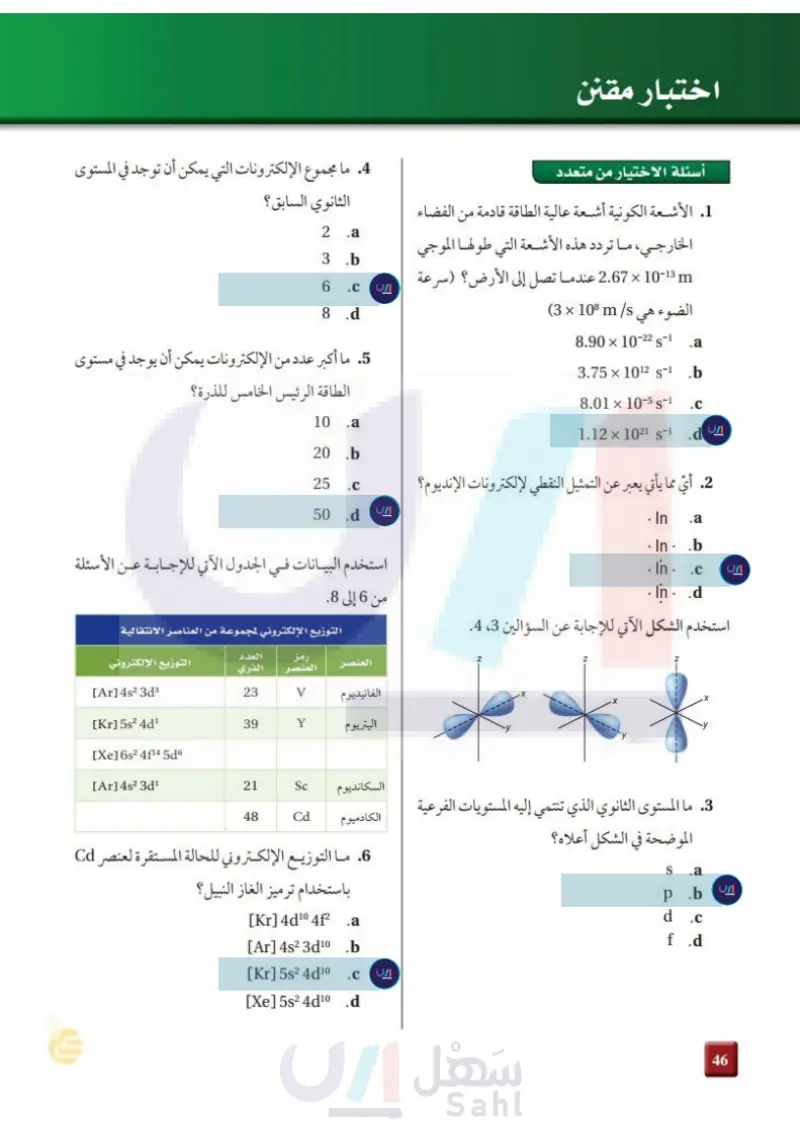
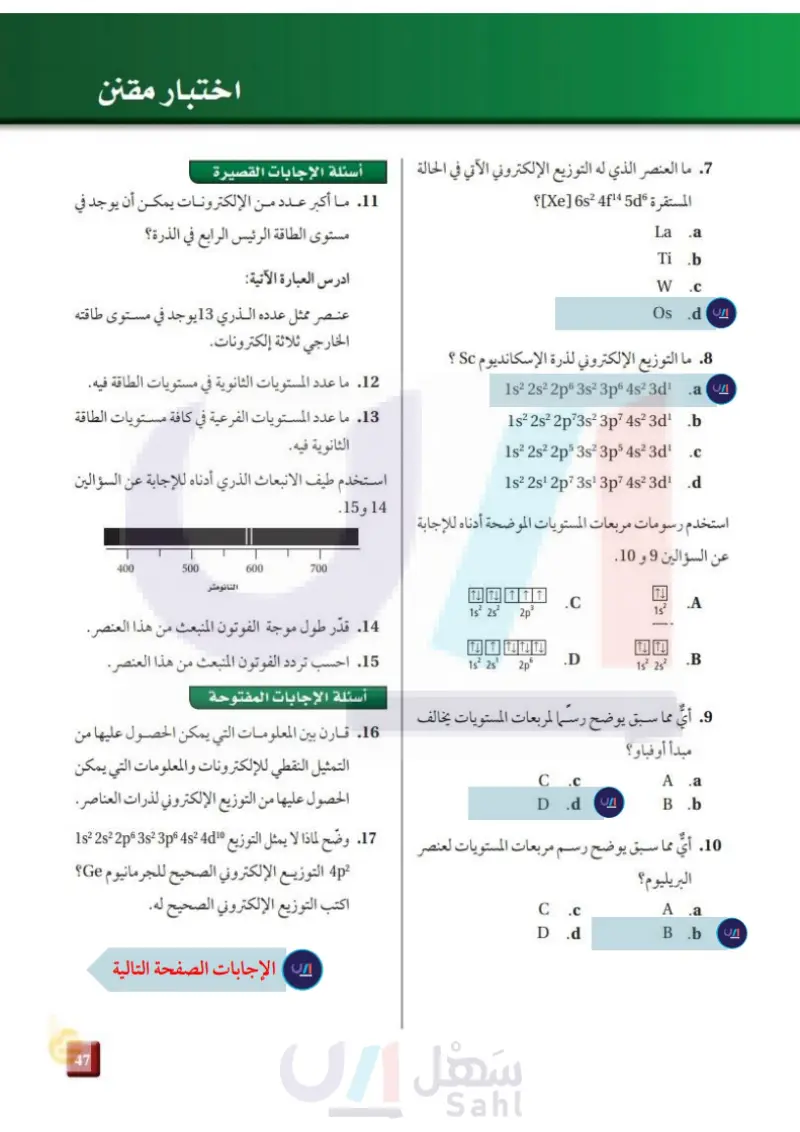
اختبار مقنن . ما العنصر الذي له التوزيع الإلكتروني الآتي في الحالة أسئلة الإجابات القصيرة المستقرة Xe] 6s2 4f14 5d]؟ 11. ما أكبر عدد من الإلكترونات يمكن أن يوجد في La .a Ti .b W .C Os .d 8 ما التوزيع الإلكتروني لذرة الإسكانديوم Sc ؟ .a 1s2 2s² 2p6 3s² 3p6 4s² 3d¹ 1s² 2s² 2p73s² 3p7 4s² 3d¹ .b 1s² 2s² 2p5 3s² 3p5 4s² 3d¹ .C 1s² 2s¹ 2p73s¹ 3p7 4s² 3d¹ .d. مستوى الطاقة الرئيس الرابع في الذرة؟ ادرس العبارة الآتية: عنصر ممثل عدده الذري 13 يوجد في مستوى طاقته الخارجي ثلاثة إلكترونات. 12. ما عدد المستويات الثانوية في مستويات الطاقة فيه. 13. ما عدد المستويات الفرعية في كافة مستويات الطاقة الثانوية فيه. استخدم طيف الانبعاث الذري أدناه للإجابة عن السؤالين استخدم رسومات مربعات المستويات الموضحة أدناه للإجابة عن السؤالين 9 و 10. ITLI A 1s² 1s² 2s 2 2p 3 14 و 15. 600 700 النانومتر 400 500 ITTL 6 .D 1s 2s 2p⁹ 1s² 2s² .B 9. أي مما سبق يوضح رسما لمربعات المستويات يخالف مبدأ أو فباو؟ A .a B.b C .c D .d 14. قدّر طول موجة الفوتون المنبعث من هذا العنصر. 15. احسب تردد الفوتون المنبعث من هذا العنصر. أسئلة الإجابات المفتوحة 16. قارن بين المعلومات التي يمكن الحصول عليها من التمثيل النقطي للإلكترونات والمعلومات التي يمكن الحصول عليها من التوزيع الإلكتروني لذرات العناصر. .10. أي مما سبق يوضح رسم مربعات المستويات لعنصر 17. وضح لماذا لا يمثل التوزيع 1s2 2s2 2p° 3s2 3p° 4s2 4d البريليوم؟ 4p التوزيع الإلكتروني الصحيح للجرمانيوم Ge؟ A .a B .b C .c D.d اكتب التوزيع الإلكتروني الصحيح له. 103 والتعليم Ministry of Education 2024-1446

قارن بين المعلومات التي يمكن الحصول عليها من التمثيل النقطي للإلكترونات والمعلومات التي يمكن الحصول عليها من التوزيع الإلكتروني لذرات العناصر





 0
0