قوانين الغازات - الكيمياء2-3 - ثاني ثانوي
الفصل1: الهيدروكربونات
الفصل2: مشتقات المركبات الهيدروكربونية وتفاعلاتها
الفصل3: كيمياء الحياة (المركبات العضوية الحيوية)
مرارة القصاص Ministry of Elication 7023-1468 الغازات Gases الفصل 41 الفكرة ( العامة تستجيب الغازات لتغيرات كل من الضغط ودرجة الحرارة والحجم وعدد الجسيمات بطرائق يمكن التنبؤ بها. 4-1 قوانين الغازات الفكرة الرئيسة إن تغير الضغط أو درجة الحرارة أو الحجم لكمية ثابتة من غاز ستؤثر على المتغيرين الآخرين. 4-2 قانون الغاز المثالي الفكرة الرئيسة يربط قانون الغاز المثالي بين عدد المولات مع كل من الضغط ودرجة الحرارة والحجم. 4-3 الحسابات المتعلقة بالغازات الفكرة الرئيسة عندما تتفاعل الغازات فإن المعاملات في المعادلات الكيميائية الموزونة التي تمثل هذه التفاعلات تشير إلى أعداد المولات والحجوم النسبية للغازات. حقائق كيميائية . درجة حرارة الهواء في المنطاد كافية لغلي الماء. استخدم العالم جوزيف جاي لوساك في القرن التاسع عشر منطاد الهواء الساخن في موقد البروبان أبحاثه وتجاربه، في حين استخدم العالم جاك شارل منطاد الهيدروجين في تجاربه. . يحتوي منطاد الهواء الساخن في المتوسط على 2.5 مليون لتر من الغاز. سلة المنطاد 538

نشاطات تمهيدية تجربة استهلالية كيف تؤثر درجة الحرارة في حجم الغاز؟ تعمل شعلة المنطاد - انظر الصفحة اليمنى - على رفع درجة حرارة الهواء داخله ليبقى محلقا في الجو. المطويات منظمات الأفكار المطويات الآتية لتساعدك قوانين الغاز اعمل على تنظيم دراسة قوانين الغاز. الخطوة 1 أحضر ثلاث خطوات العمل BE 1. اقرأ تعليمات السلامة في المختبر. 2 انفخ بالونا ثم اربطه. 3. اسكب ماءً باردًا في دلو إلى منتصفه، ثم أضف إليه قطع من الثلج. 4. استخدم خيطا لقياس محيط البالون في درجة حرارة الغرفة. 5 حرك الماء والثلج في الدلو جيدا، حتى تثبت درجة حرارته، ثم اغمر البالون في الماء والثلج مدة 15 دقيقة. 6. أخرج البالون من الماء، ثم قس محيطه. التحليل 1. صف ما حدث لحجم البالون عندما غُمر في حوض الماء والثلج. 2 توقع ما يحدث لحجم البالون لو كان الدلو يحتوي ماءً ساخنا. استقصاء ماذا يحدث إذا ملأت البالون بالهيليوم بدلاً من الهواء، وأجريت التجربة مرة أخرى؟ ورقات، وضع بعضها فوق بعض، ودع حوافها العليا متباعدة رأسيا بمقدار 2cm الخطوة 2 اثن الأطراف السفلية للأوراق على أن تكون خمس طيات متساوية. ثم اضغط على الثنيات لتثبيتها في أماكنها. الخطوة 3 ثبت المطوية، قوانين الغازات كما في الشكل، وعنون قانون بويل قانون مادار قانون جاي - توست الطيات على النحو الآتي: القانون العام القانون المنافية قوانين الغاز، بويل شارل، جاي لوساك، القانون العام، قانون الغاز المثالي. المطريات استخدم هذه المطوية في أثناء قراءة القسمين 1-4 و 2-4. لخص قوانين الغازات بكلماتك الخاصة. وزارة التعليم Minis 539 ductations 2073-1445

المطويات
رابط : 4-1 الأهداف قوانين الغازات The Gas Laws www.icn.edu.sa الفكرة الرئيسة إن تغير الضغط أو درجة الحرارة أو الحجم لكمية ثابتة مــن غـاز ستؤثر على الربط مع الحياة ماذا يحدث لغاز في بالون إذا قللت حجمه بالضغط عليه؟ ستشعر تكتب العلاقة بين الضغط ودرجة الحرارة والحجم لمقدار المتغيرين الآخرين. ثابت من الغاز. تطبق قوانين الغاز على المسائل بزيادة في المقاومة، وقد تشاهد انتفاخا في جزء من البالون. التي تتضمن الضغط ودرجة الحرارة والحجم لمقدار عدد قانون بويل Boyle's Law من الغاز. مراجعة المفردات القانون العلمي: يصف علاقة في ضغط الغاز وحجمه مترابطان. وقد وصف العالم الأيرلندي روبرت بويل (1627-1691م) هذه العلاقة. كيف يرتبط الضغط مع الحجم ؟ لقد صمّم بويل تجربة كالمبينة في الشكل 1-4، ووضح من خلالها أنه إذا كانت كمية الغاز ودرجة الحرارة ثابتتين فإن مضاعفة الضغط الواقع على الطبيعة تدعمها عدة تجارب. الغاز يقلل من حجمه إلى النصف. ومن ناحية أخرى فإن تقليل الضغط الواقع على الغاز إلى النصف يضاعف حجم الغاز. وتعرف العلاقة التي يزيد فيها أحد المتغيرين عندما يقل الآخر بعلاقة التناسب العكسي. المفردات الجديدة قانون بویل الصفر المطلق قانون شارل قانون جاي - لوساك القانون العام للغازات ينص قانون بويل على أن حجم كمية محددة من الغاز يتناسب عكسيا مع الضغط الواقع عليه عند ثبوت درجة حرارته يبين الشكل 1-4 العلاقة العكسية بين الضغط والحجم، حيث يتجه المنحنى إلى أسفل. الشكل 1-4 عندما يزيد الضغط الخارجي على مكبس الأسطوانة يقل حجم الغاز داخل الأسطوانة. ويوضح الرسم البياني الآتي العلاقة العكسية بين الضغط والحجم. 10 8 التغيرة الحجم - الضغط (1,0 atm, 10 L) (2.0 atm, 5 L) 2 (4.0 atm, 2.5 L) 0 0.5 1.0 1.5 3.5 3.0 2.0 2.5 4.0 الضغط (alm) استخدم الرسم البياني طبق استخدم الرسم لتحديد الحجم، إذا كان مقدار الضغط 2:5am وزارة التعليم Ministry of Education 2023-1445 25°C 10 L 1 atm SL- 25°C 25°C 2 atm 4 atm PV = (1 atm)(101) = 10 atm. L P₂V₂ = (2 atm)(5 L) = 10 atm - L 2.5L P3V3 = (4 atm)(2.5 L) = 10 atm - L ثابت = ثابت = ثابت = 540

أهداف درس قوانين الغازات
لاحظ أن ناتج ضرب الضغط في الحجم عند كل نقطة في الشكل 1-4 يساوي atm L 10 لذا يمكن التعبير عن قانون بويل رياضيا على النحو الآتي: قانون بويل PV = P2V2 P: تمثل الضغط ٧٠ : تمثل الحجم تجربة رعملية قانون بويل ارجع إلى دليل التجارب العملية على حاصل ضرب ضغط كمية محددة من الغاز في حجمها عند ثبوت درجة حرارتها يساوي منصة عين الإثرائية كمية ثابتة. يمثل كل من و الضغط والحجم الابتدائيين، في حين يمثل كل من P2 و V2 الضغط والحجم الجديدين، فإذا علمت ثلاثة من المتغيرات الموجودة في المعادلة أمكنك معرفة قيمة المتغير الرابع. مثال 1-4 قانون بويل ينفخ غواص وهو على عمق 10m تحت الماء فقاعة هواء حجمها L 0.75، وعندما ارتفعت فقاعة الهواء إلى السطح تغير ضغطها من atm 2.25 إلى atm 1.03 ، ما حجم فقاعة الهواء عند السطح ؟ تحليل المسألة بالاعتماد على قانون بويل، بنقصان الضغط على فقاعة الهواء يزداد حجمها، لذا يجب ضرب الحجم الابتدائي لها في نسبة ضغط أكبر من 1. المعطيات المطلوب V2 = ? L V = 0.75 L P₁ = 2.25 atm P2 = 1.03 atm حساب المطلوب استخدم قانون بويل لإيجاد قيمة V2 واحسب الحجم الجديد. PV = P2V2 V2 = V V2 = 0.75 L | (2.25 atm (1.03 atm) V2 = 0.75 L (2.25 atm (1.03 atm) = 1.6 L ضع نص قانون بويل جد قيمة عوض L. P = 2.25 atm. P2= 1.03 atm 0.75=, اضرب الأرقام والوحدات واقسمها تقويم الإجابة قل الضغط بمقدار النصف تقريبًا، لذا فإن الحجم سيزيد إلى الضعف ويعبر عن الإجابة بوحدة اللتر، وهي وحدة قياس الحجم، وتحتوي الإجابة على رقمين معنويين، وهذا صحيح. مسائل تدريبية افترض أن درجة الحرارة وكمية الغاز ثابتان في المسائل الآتية: 1. إذا كان حجم غاز عند ضغط kPa 99.0 هو mL 300.0 ، وأصبح الضغط kPa 188 فما الحجم الجديد؟ 2. إذا كان ضغط عينة من غاز الهيليوم في إناء حجمه 1.00 هو atm 0.988 فما مقدار ضغط هذه العينة إذا نقلت إلى وعاء حجمه . L 2.00؟ 3. تحفيز إذا كان مقدار حجم غاز محصور تحت مكبس أسطوانة 145.7، وضغطه atm 208، فيها . عندما يزداد الضغط بمقدار 25؟ وزارة التعليم Minishof Education 2023-1445

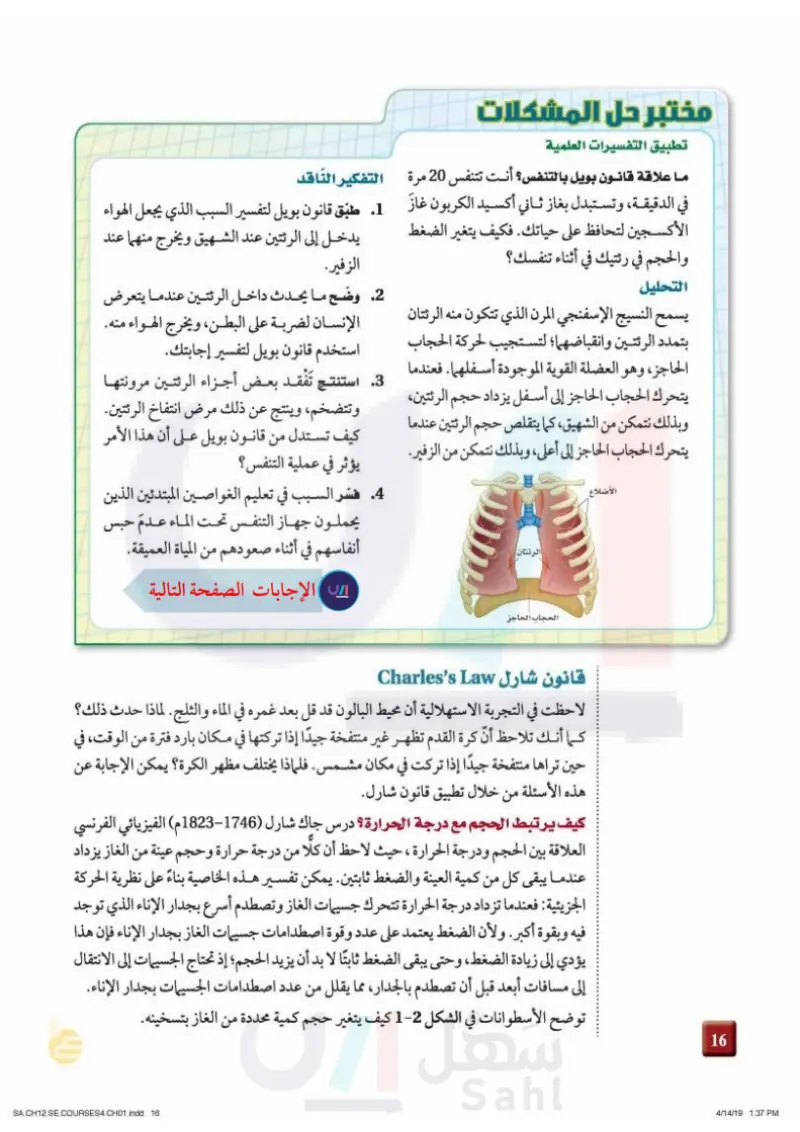
مختبر حل المشكلات تطبيق التفسيرات العلمية ما علاقة قانون بويل بالتنفس؟ أنت تتنفس 20 مرة التفكير الناقد في الدقيقة، وتستبدل بغاز ثاني أكسيد الكربون غاز 1 طبق قانون بويل لتفسير السبب الذي يجعل الهواء الأكسجين لتحافظ على حياتك. فكيف يتغير الضغط يدخل إلى الرئتين عند الشهيق ويخرج منهما عند والحجم في رئتيك في أثناء تنفسك؟ التحليل يسمح النسيج الإسفنجي المرن الذي تتكون منه الرئتان بتمدد الرئتين وانقباضهما؛ لتستجيب لحركة الحجاب الحاجز، وهو العضلة القوية الموجودة أسفلهما. فعندما يتحرك الحجاب الحاجز إلى أسفل يزداد حجم الرئتين وبذلك نتمكن من الشهيق كما يتقلص حجم الرئتين عندما يتحرك الحجاب الحاجز إلى أعلى، وبذلك نتمكن من الزفير الأضلاع الرئتان الزفير. .2 وضح ما يحدث داخل الرئتين عندما يتعرض الإنسان لضربة على البطن، ويخرج الهواء منه. استخدم قانون بويل لتفسير إجابتك. 3 استنتج تفقد بعض أجزاء الرئتين مرونتها وتتضخم، وينتج عن ذلك مرض انتفاخ الرئتين. كيف تستدل من قانون بويل على أن هذا الأمر يؤثر في عملية التنفس؟ 4. فسر السبب في تعليم الغواصين المبتدئين الذين يحملون جهاز التنفس تحت الماء عدم حبس أنفاسهم في أثناء صعودهم من المياة العميقة. 542 الحجاب الحاجز قانون شارل Charles's Law لاحظت في التجربة الاستهلالية أن محيط البالون قد قل بعد غمره في الماء والثلج. لماذا حدث ذلك؟ كما أنك تلاحظ أن كرة القدم تظهر غير منتفخة جيدًا إذا تركتها في مكان بارد فترة من الوقت في حين تراها منتفخة جيدًا إذا تركت في مكان مشمس. فلماذا يختلف مظهر الكرة؟ يمكن الإجابة عن هذه الأسئلة من خلال تطبيق قانون شارل كيف يرتبط الحجم مع درجة الحرارة؟ درس جاك شارل (1746-1823م) الفيزيائي الفرنسي العلاقة بين الحجم ودرجة الحرارة ، حيث لاحظ أن كلا من درجة حرارة وحجم عينة من الغاز يزداد عندما يبقى كل من كمية العينة والضغط ثابتين يمكن تفسير هذه الخاصية بناءً على نظرية الحركة الجزيئية: فعندما تزداد درجة الحرارة تتحرك جسيمات الغاز وتصطدم أسرع بجدار الإناء الذي توجد فيه وبقوة أكبر. ولأن الضغط يعتمد على عدد وقوة اصطدامات جسيمات الغاز بجدار الإناء فإن هذا يؤدي إلى زيادة الضغط، وحتى يبقى الضغط ثابتا لا بد أن يزيد الحجم؛ إذ تحتاج الجسيمات إلى الانتقال إلى مسافات أبعد قبل أن تصطدم بالجدار، مما يقلل من عدد اصطدامات الجميعانت بـ ت بعد از الإناء. توضح الأسطوانات في الشكل 2- كيف يتغير حجم كمية محددة من الغاز بتسخينه. وزارة التعليم Ministry of Education 2023-1445

800 600 الحجم مقابل درجة الحرارة (C) 400 (-123°C, 300 mL) 200 (27°C, 600 mL) -300-250-200 -150 -100-50 800 600 400 200 درجة الحرارة (C) الحجم مقابل درجة الحرارة (K) 0 50 الشكل 42 عند تسخين الأسطوانة تزداد الطاقة الحركية لجسيمات الغاز، فتدفع الجسيمات المكبس إلى أعلى، يوضح الرسم البياني الآتي علاقة الحجم بدرجة الحرارة السيليزية ودرجة الحرارة المطلقة (300 K, 600 mL) 150 K (150 K, 300 mL) atm -600 mL -300 mL 300 K V₁ 300 ml 2 T, 150K 600 ml 300 K 50 100 150 300 200 250 350 - 2 mL/K 2 mL/K درجة الحرارة (K) ثابت = ثابت = وعلى عكس الشكل 1-4 إذ يؤثر في المكبس ضغط خارجي بالإضافة إلى الضغط الجوي، فقد بقي المكبس في الشكل 2-4 حر الحركة. وهذا يعني قيام الغاز الموجود في الأسطوانة برفع المكبس إلى أن يتساوى الضغط الواقع عليه مع الضغط الجوي. وكما تلاحظ يزداد حجم الغاز المحصور عند atm 1 بزيادة درجة الحرارة في الأسطوانة، لذا تكون المسافة التي يتحركها المكبس مقياسًا لزيادة حجم الغاز عندما يسخن. رسم العلاقة بين درجة الحرارة والحجم يوضح الشكل 4 أيضًا العلاقة بين درجة الحرارة والحجم لمقدار محدّد من الغاز تحت تأثير ضغط ثابت؛ حيث إن منحنى درجة الحرارة مع الحجم خط مستقيم، فيمكنك توقع درجة الحرارة التي يصبح الحجم عندها OL، وذلك بمد الخط إلى درجات حرارة أدنى من الدرجات التي تم قياسها. في الرسم البياني الأول درجة الحرارة التي يكون عندها الحجم L تساوي 273°C−، لذا فهذه العلاقة خطية، لكنها ليست تناسبًا مباشرًا. فمثلا يمكنك ملاحظة عدم مرور الخط المستقيم بنقطة الأصل، كما أن مضاعفة درجة الحرارة من 25 إلى 50C لا تؤدي إلى مضاعفة الحجم. يبين الرسم البياني في الشكل 2- أن العلاقة بين درجة الحرارة المقيسة بالكلفن (K) والحجم علاقة طردية والتناسب مباشر؛ إذ تقابل درجة الحرارة K حجما مقداره 0mL، وعند مضاعفة درجة الحرارة يتضاعف الحجم. ويعرف الصفر على تدريج كلفن بالصفر المطلق، وهو يمثل أقل قيمة ممكنة لدرجة الحرارة التي تكون عندها طاقة الذرات أقل ما يمكن. اختبار الرسم البياني فسّر لماذا يوضح الرسم البياني الثاني في الشكل 2-4 تناسبا " طرديا مباشرًا، في حين لا يوضح الرسم البياني الأول ذلك. وزارة التعليم 543 Minishof Education 2073-1445

تجرية عملية قانون شارل ارجع إلى دليل التجارب العملية على منصة عين الإثرائية مثال 2-4 استخدام قانون شارل ينص قانون شارل على أن حجم كمية محددة من الغاز يتناسب طرديا مع درجة حرارته بالكلفن عند ثبوت الضغط، ويمكن التعبير عن قانون شارل بالعلاقة الرياضية الآتية: قانون شارل V₁ V2 = TH T2 تمثل الحجم تمثل درجة الحرارة بالكلفن حاصل قسمة حجم كمية محددة من الغاز على درجة حرارته بالكلفن عند ثبوت ضغطه يساوي كمية ثابتة. تتمثل TV في المعادلة أعلاه درجة الحرارة والحجم الابتدائيين، في حين تمثل V، 12 درجة الحرارة والحجم الجديدين، كما في قانون بويل، فإذ عرفت ثلاث متغيرات أمكنك حساب المتغير الرابع. وعند استخدام قانون شارل يجب التعبير عن درجة الحرارة بالكلفن. وكما قرأت سابقا، عليك إضافة 273 إلى درجة الحرارة السيليزية لتحويل درجة الحرارة من التدريج السيليزي إلى التدريج بالكلفن: Tx = 273 + Tc قانون شارل إذا كان حجم بالون هيليوم 2.321 داخل سيارة مغلقة، عند درجة حرارة 40.0، فإذا وقفت السيارة في ساحة البيت في يوم حار وارتفعت درجة الحرارة داخلها إلى °75.0°C ، فما الحجم الجديد للبالون إذا بقي الضغط ثابتا ؟ تحليل المسألة ينص قانون شارل على أن حجم مقدار محدّد من الغاز يزداد بزيادة درجة حرارته إذا بقي الضغط ثابتا. لذا يزداد حجم البالون ، ويجب ضرب الحجم الابتدائي في نسبة درجة حرارة أكبر من واحد. وزارة التعليم Ministry of Education 7073-1445 Tx = 273 + T T1 = 273 + 40.0°C = 313.0K T2 = 273 + 75.0°C = 348.0 K المطلوب V2 = ? L المعطيات T₁ = 40.0°C V₁ = 2.32 L T 2 = 75.0°C حساب المطلوب حوّل درجة الحرارة السيليزية إلى الكلفن. استخدم معامل التحويل عوض بقيمة 40.0 = T عوض بقيمة T2 = 75.0°C 544

استخدم قانون شارل لإيجاد V ، وعوض بالقيم المعروفة في المعادلة التي أُعيد ترتيبها. اكتب نص قانون شارل جد قيمة V عوض V, = 2.32 L. T = 313.0K. T2 = 348.0 K اضرب واقسم الوحدات والأرقام تقويم الإجابة V2 = Vi V₂ = 2.32 L (348.0 K 313.0K Vz = 2.32 L (343.0K) = 2.58 L كانت الزيادة في درجة الحرارة بالكلفن صغيرة نسبيًا، لذا ستكون الزيادة في الحجم صغيرة أيضًا، وستستخدم وحدة (L) في الإجابة، وهي وحدة الحجم وهناك ثلاثة أرقام معنوية. مسائل تدريبية افترض أن الضغط وكمية الغاز ثابتان في المسائل الآتية: 4. ما الحجم الذي يشغله الغاز في البالون الموجود على اليسار عند درجة 250K؟ 5. شغل غاز عند درجة حرارة C 89 حجماً مقداره (0.67). عند أي درجة حرارة سيليزية سيزيد الحجم ليصل إلى 1.12 ؟ 6. إذا انخفضت درجة الحرارة السيليزية لعينة من الغاز حجمها 3.0L من 80.00 إلى 30.0 فما الحجم الجديد للغاز؟ 7. تحفيز يشغل غاز حجما مقداره 1 0.67 عند درجة حرارة (350). ما درجة الحرارة اللازمة لخفض الحجم بمقدار %45 ؟ قانون جاي - لوساك Gay- Lussac's Law لاحظت في التجربة الاستهلالية تطبيقات على قانون شارل، فعند تغير درجة الحرارة يتغير حجم البالون، ولكن ماذا يمكن أن يحدث لو كان البالون صلبا ثابتا؟ وإذا كان حجمه ثابتا فهل هناك علاقة بين درجة الحرارة والضغط ؟ يمكن الإجابة عن هذا السؤال من خلال قانون جاي - لوساك كيف ترتبط درجة الحرارة مع ضغط الغاز؟ ينتج الضغط عن اصطدام جسيمات الغاز بجدران الوعاء؛ فكلما ارتفعت درجات الحرارة زاد عدد الاصطدامات وطاقتها. لذا تؤدي زيادة الحرارة إلى زيادة الضغط إذا لم يتغير الحجم. 4.3 L 350 K وزارة التعليم Mini 545 Education 2073-1445

الشكل 3-4 عند تسخين الأسطوانة تزداد الطاقة الحركية للجسيمات، مما يؤدي إلى زيادة اصطداماتها بجدار الإناء وزيادة قوتها، ولأن حجم الأسطوانة ثابت فإن ضغط الغاز يزداد. الضغط مقابل درجة الحرارة (K) 4.0 3.5 3.0 2.5 2.0 (300 K, 3.0 atm) 1 atm 1.5 (150 K, 1.5 atm) 1.0 0.5 0 0 100 200 300 400 500 600 درجة الحرارة (K) استخدم الرسم البياني قارن بين الرسوم البيانية في الشكلين 2-4 و 3-4 1.0 L 1.0 L 150 K 300 K Pi 1.5 atm = 150 K = 0.01 atm/K ثابت = 2 atm P₂ 3.0 atm 300 K = 0.01 atm/K ثابت = الكيمياء في واقع الحياة قانون جاي لوساك وقد وجد جاي لوساك (1778-1850م) أن درجة الحرارة المطلقة تتناسب طرديا مع الضغط، كما هو موضح في الشكل 3-4. وينص قانون جاي لوساك على أن ضغط مقدار محدد من الغاز يتناسب طرديا مع درجة الحرارة بالكلفن اله عند ثبوت الحجم. ويمكن التعبير عنه رياضيا كما يأتي: ) P تمثل الضغط T تمثل درجة الحرارة بالكلفن قانون جاي لوساك P2 = T T أواني الضغط الوعاء الضغط غطاء حاصل قسمة الضغط على درجة الحرارة بالكلفن المقدار محدد من الغاز ذي حجم ثابت يساوي مقدارا ثابتا. وكما هو الحال في قانوني بويل وشارل ، فإذا عرفت ثلاثة متغيرات أمكنك محكم الإغلاق، وحجمه ثابت. وعند حساب المتغير الرابع باستخدام المعادلة تذكر أن درجة الحرارة يجب أن تكون تسخينه يزداد الضغط في الإناء، بالكلفن (K) أينما استخدمت في معادلات قوانين الغاز. وبزيادة الضغط تستمر درجة الحرارة في الارتفاع، فيتم بذلك طهو الطعام وزارة التعليم Ministry of Education 2023-1445 بسرعة أكبر 546

مثال 3-4 قانون جاي- لوساك إذا كان ضغط غاز الأكسجين داخل الأسطوانة atm 5.00 عند درجة 25.0°C ، ووضعت الأسطوانة في خيمة على قمة جبل إفرست، حيث تكون درجة الحرارة 10.0°C- فما الضغط الجديد داخل الأسطوانة؟ تحليل المسألة ينص قانون جاي لوساك على أنه إذا انخفضت درجة حرارة الغاز المحصور فإن ضغطه ينخفض إذا بقي حجمه ثابتا . لذلك يقل الضغط في أسطوانة الأكسجين. يجب ضرب مقدار الضغط الابتدائي في نسبة درجة حرارة أقل من 1. المعطيات المطلوب P2 = ? atm Tx = 273 + To P₁ = 5.00 atm T₁ = 25.0°C T2 = -10.0 °C حساب المطلوب حول درجات الحرارة السيليزية إلى كلفن استخدم معامل التحويل عوض T = 25.0 C عوض T2 = 10.0 C T1 = 273 + 25.0 °C = 298.0 K T2 = 273 + (-10.0 °C) = 263.0 K استخدم قانون جاي لوساك؛ لإيجاد قيمة P، وعوض بالقيم المعروفة في المعادلة التي أعيد ترتيبها. اكتب نص قانون جاي لوساك P2 = P1 Pz = 5.00 atm 263.0 K 298.0 K P₂ = 5.00 atm (2630) K = 4.41 atm لإيجاد قيمة P عوض P,= 5.00 atm، T = 298.0K. T2 = 263.0K اضرب الأرقام والوحدات واقسمها. تقويم الإجابة تقل درجة الحرارة المطلقة، لذا يقل الضغط وحدة الضغط atm، وهناك ثلاثة أرقام معنوية. مسائل تدريبية افترض أن الحجم و كمية الغاز ثابتان في المسائل الآتية: 8. إذا كان ضغط إطار سيارة atm 1.88 عند درجة حرارة °25 ، فكم يكون الضغط إذا ارتفعت درجة الحرارة إلى $37.0°C 9 يوجد غاز هيليوم في أسطوانة حجمها 2L، تحت تأثير ضغط جوي مقداره 1.12atm، فإذا أصبح ضغط الغاز 2.56 atm عند درجة حرارة 36.5 ، فما قيمة درجة حرارة الغاز الابتدائية؟ 10. تحفيز إذا كان ضغط عينة من الغاز يساوي Ka 30.7 عند درجة حرارة C 00.0، فكم منيعي أن ترتفع درجة الحرارة السيليزية للعينة حتى يتضاعف ضغطها ؟ وزارة العليم Education Minis 547 2073-1445

548 الشكل 4-4 تمتلك المملكة العربية السعودية ما يزيد عن 10 محطات رصد جوي والتي يُستخدم فيها بالون الطقس كما في الشكل المجاور والذي تتم تعبئته بالهيليوم أو الهيدروجين - ويحمل بالون الطقس على متنه أجهزة تسمى ( راديو سوند ) ترسل بيانات تتعلق بدرجة حرارة الهواء والضغط والرطوبة في طبقات الجو العليا، إضافة لذلك، يساعد متابعة العلماء في معرفة سُرعة واتجاه الرياح على تلك الارتفاعات. القانون العام للغازات The General Gas Law يمكن أن يتغير كل من الضغط ودرجة الحرارة والحجم في العديد من التطبيقات العملية للغازات، كما في بالون الطقس في الشكل -4-4. كما يمكن جمع قانون مهن في الكيمياء بويل وقانون شارل وقانون جاي لوساك في قانون واحد يطلق عليه القانون العام للغازات، وهو يحدّد العلاقة بين الضغط ودرجة الحرارة والحجم لكمية الأرصاد الجوية العلاقات التي تربط محدّدة من الغاز. ويوجد بين المتغيرات الثلاثة نفس العلاقة الموجودة في القوانين الضغط ودرجة الحرارة مع الحجم تساعد الأخرى. فالضغط يتناسب مكا مع الحجم، وطرديا مع درجة الحرارة. علماء الأرصاد الجوية على فهم حالة الطقس ويمكن التعبير عن القانون العام للغازات رياضيا على النحو الآتي: والتنبؤ بها ، فمثلا تنتج الرياح والجبهات الهوائية عن تغير الضغط الذي يسببه التسخين الشمسي غير المنتظم للغلاف الجوي المحيط بسطح الأرض. القانون العام للغازات P,V, = T₁ P2V2 T2 P = تمثل الضغط ، V = تمثل الحجم T = تمثل درجة الحرارة بالكلفن حيث حاصل ضرب الضغط في الحجم مقسوما على درجة الحرارة بالكلفن المقدار محدد من الغاز يساوي مقدارا ثابتا. استخدام القانون العام للغازات يساعدك القانون العام للغازات على حل المسائل التي تتضمن أكثر من متغير واحد، كما يقدم لك طريقة لتذكر القوانين الثلاثة الأخرى دون تذكر معادلاتها، يمكننا القانون العام للغازات من اشتقاق القوانين الأخرى من خلال تذكر المتغير الثابت في كل حالة. مثلا إذا بقيت درجة الحرارة ثابتة بينما تغير الضغط والحجم فإن T=T. وبعد تبسيط قانون الغاز العام تحت هذه الظروف ستجد أن المعادلة أصبحت P,V, PV2، والتي ينبغي أن تستنتج أنها قانون بويل. ا ماذا قرأت اشتق قانون ،شارل، وقانون جاي الوشماك من القانون العام للغازات. وزارة التعليم Ministry of Education 2023-1445

مثال 4-4 القانون العام للغازات إذا كان حجم كمية من غاز ما تحت ضغط 110KPa، ودرجة حرارة 30.0 يساوي L 2.00 وارتفعت درجة الحرارة إلى 80.0C ، وزاد الضغط وأصبح 440KPa، فما مقدار الحجم الجديد؟ تحليل المسألة تغير كل من درجة الحرارة والضغط ؛ لذلك يجب أن تستخدم القانون العام للغازات. لقد زاد الضغط أربع مرات، لكن درجة الحرارة لم تتضاعف بنفس هذا المقدار، لذلك فإن الحجم الجديد سيكون أقل من الحجم الابتدائي. المعطيات المطلوب V2 = ? L P₁ = 110 kPa T₁ = 30.0°C P2 = 440 kPa T₂ = 80.0 °C V = 2.00 L حل المطلوب حوّل درجات الحرارة من السيليزية إلى كلفن. Tx = 273 + Te T1 = 273 + 30.0°C = 303.0 K T2 = 273 + 80.0°C = 353.0 K طبق معامل التحويل عوض T = 30.0°C عوض T2 = 30.0°C استخدم قانون الغازات العام، لتجد قيمة V2 ثم عوض القيم المعروفة في المعادلة التي أعيد ترتيبها. P,V, P2V2 Ti V2 = Vi V2=2.00 L 110 kPa)/353.0 K 440 kPa 303.0 K V2 = 2.00 L 110 kPa\/353.0 K 440 kPa = 0.58 L اكتب القانون العام للغازات حل لإيجاد V2 عوض .P,= 110kPa. P2= 440 kPa. T = 303.0K T2=353.0 K اضرب الأرقام والوحدات واقسمها تقويم الإجابة تغير الضغط بشكل أكبر من درجة الحرارة، لذا فقد قل الحجم. الوحدة هي (L)، وهي حدة قياس الحجم، وهناك رقمان معنويان. مسائل تدريبية افترض أن كمية الغاز ثابتة في المسائل الآتية: 0.00°C 11. تُحدث عينة من الهواء في حقنة ضغطًا مقداره atm 1.02، عند 22.0°C، ووضعت هذه الحقنة في حمام ماء يغلي (درجة حرارة 100.0C) وازداد الضغط إلى 1.23atm بدفع مكبس الحقنة إلى الخارج، مما أدى إلى زيادة الحجم إلى m 0.224 فكم كان الحجم الابتدائي؟ 12. يحتوي بالون على 146.0mL من الغاز المحصور تحت ضغط مقداره atm 1.30 ودرجة حرارة 5.0°C فإذا تضاعف الضغط وانخفضت درجة الحرارة إلى %2.0°C فكم يكون حجم الغاز في البالون؟ 13، تحفيز إذا زادت درجة الحرارة في الإسطوانة الموجودة على يسارك لتصل إلى 30.0°C ، وزاد الضغط إلى atm 1.20 فهل يتحرك مكبس الأسطوانة إلى أعلى أم إلى أسفل ؟ 1.00 atm 30.0 ml وزارة التعليم Mini 549 Education 2073-1445

الجدول 1-4 القانون قوانين الغازات بويل شارل جاي لوساك القانون العام VV2 الصيغة PV = P2V2 P₁ P2 T, T PV_P2V2 T2 Ti ما الثابت؟ كمية الغاز ودرجة الحرارة كمية الغاز والضغط كمية الغاز والحجم كمية الغاز رسم تنظيمي مقاييس درجة الحرارة وقوانين الغازات لا بد أنك لاحظت أن العمل الذي قام به كل من شارل وجاي - لوساك قد سبق تطوير التدريج بالكلفن (K)، على الرغم من أن قانونيهما تطلبا استخدام درجة الحرارة بالكلفن (K) . حيث استخدم العلماء في القرن 17 وبدايات القرن 18 مقاييس حرارة مختلفة. فعلى سبيل المثال استخدم تدريج ريومر في فرنسا حتى في العصر نفسه الذي عاش فيه شارل تقريبا. وباستخدام هذا التدريج أو أي تدريج لا يعتمد على الصفر المطلق أدخل معلومات من هذا تصبح المعادلة التي تعبر عن قانون شارل أكثر تعقيدًا؛ فهي تحتاج إلى ثابتين إضافة إلى الحجم V القسم في مطويتك. ودرجة الحرارة .T . وقد بسّط التدريج بالكلفن الأمور، ونتجت قوانين الغازات المستخدمة الآن. عرفت الآن كيف تؤثر متغيرات الضغط والحرارة والحجم في عينة من الغاز. ويمكنك أيضًا المطويات التقويم 1-4 الخلاصة استخدام قوانين الغازات التي تم تلخيصها في الجدول 1-4 إذا كانت كمية الغاز ثابتة، لكن ماذا يحدث إذا تغيرت كمية الغاز؟ هذا ما ستدرسه لاحقا. :14. الفكرة الرئيسة وضح العلاقة بين الضغط ودرجة الحرارة وحجم كمية ثابتة من الغاز. ينص قانون بويل على أن حجم مقدار : 15 اشرح أي المتغيرات الثلاثة، التي تؤثر في كمية ثابتة من الغاز، تتناسب تناسبا محدد من الغاز يتناسب عكسيا مع طرديا، وأيها تتناسب عكسياً؟ ضغطه عند ثبوت درجة الحرارة. : 16 حلل أطلق بالون طقس إلى الغلاف الجوي، وأنت تعرف كلا من حجمه الابتدائي ينص قانون شارل على أن حجم كمية ودرجة حرارته وضغط الهواء فيه. ما المعلومات التي تحتاج إليها لحساب الحجم النهائي محدّدة من الغاز يتناسب طرديا مع درجة للبالون عندما يصل إلى أقصى ارتفاع له؟ وأي القوانين تستخدم لحساب الحجم؟ حرارته بالكلفن عند ثبوت الضغط. 17. استنتج لماذا تضغط الغازات التي تستخدم في المستشفيات، ومنها الأكسجين؟ ينص قانون جاي لوساك على أن ولماذا يجب حمايتها من ارتفاع درجات الحرارة؟ وماذا يجب أن يحدث للأكسجين ضغط مقدار محدد من الغاز يتناسب المضغوط قبل استنشاقه؟ طرديا مع درجة الحرارة بالكلفن 18. احسب يحتوي إناء بلاستيكي صلب على 100 من غاز الميثان عند ضغط جوي مقداره torr 660، ودرجة حرارة 22.0 ، ما مقدار الضغط الذي يحدثه الغاز عند ثبوت الحجم. يربط القانون العام للغازات بين عند ارتفاع درجة الحرارة إلى 44.6°C؟ الضغط ودرجة الحرارة والحجم في 19. صمم خريطة مفاهيمية توضح فيها العلاقات بين الضغط والحجم ودرجة الحرارة معادلة واحدة. في قوانين بويل، وشارل، وجاي لوساك. 550 وزارة التعليم Ministry of Education 2023-1445




 0
0