قوانين فاراداي - الكيمياء - سادس اعدادي
التمهيد
الفصل الأول: الثرموداينمك
الفصل الثاني: الاتزان الكيميائي
الفصل الثالث: الاتزان الايوني
الفصل الرابع: تفاعلات التأكسد والاختزال والكيمياء الكهربائية
الفصل الخامس: الكيمياء التناسقية
الفصل السادس: طرائق التحليل الكيميائي
الفصل السابع: الكيمياء العضوية للهيدروكاربونات المعوضة
الفصل الثامن: الكيمياء الحياتية

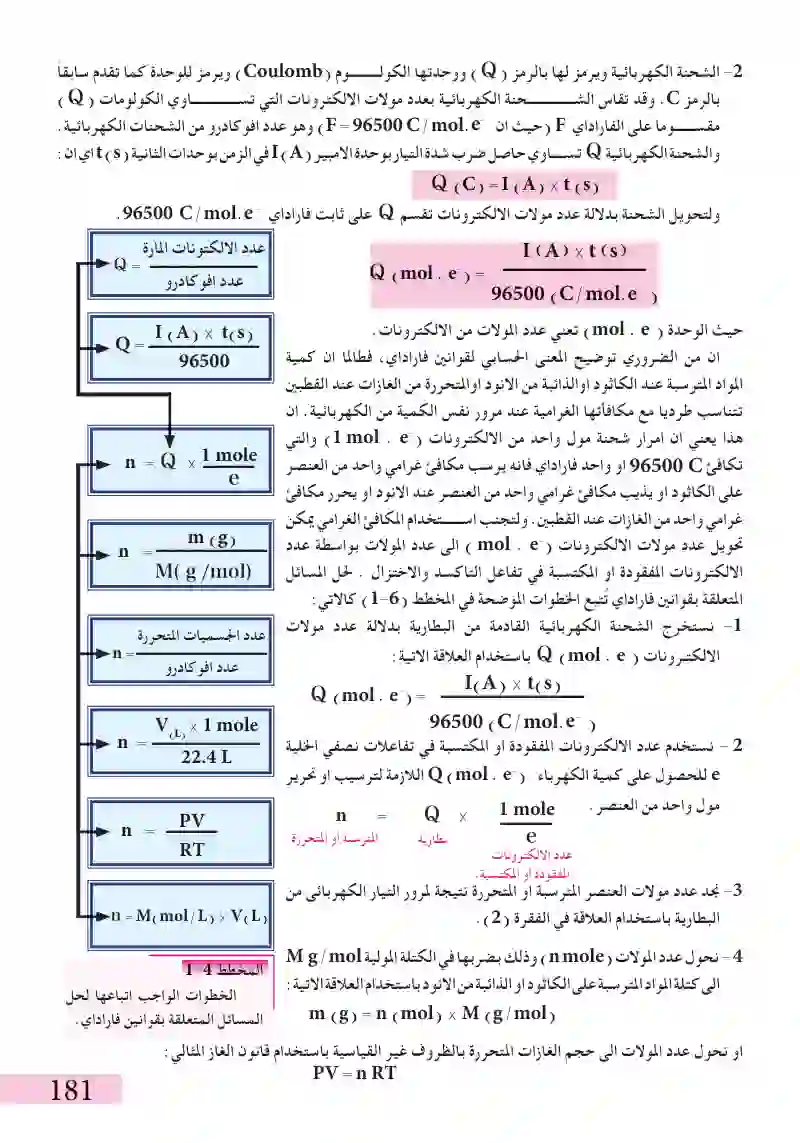
احسب عدد غرامات المغنيسيوم التي يمكن انتاجها من فلز المغنيسيوم عند إمرار تيار شدته A 25 لفترة ساعة واحدة (hr 1). علما أن الكتلة الذرية للمغنيسيوم تساوي 24. ماهي عدد ذرات المغنيسيوم المترسبة ع



لم يتم إضافة أي تعليقات حتى الآن.
الرجاء تسجيل الدخول لكتابة تعليق