قوانين الغازات - فيزياء - ثاني ثانوي
الوحدة الأولى: الموجات
الوحدة الثانية: الموائع
الوحدة الثالثة الحرارة الفصل الخامس الفصل الخامس قوانين الغازات قوانين الغازات مقدمة يمكن إدراك أن جزيئات الغاز في حالة حركة عشوائية مستمرة من خلال دراسة الحركة البراونية کمایلی : ا - جزيئات غاز تتحرك حركة ب - جزيئات سائل تتحرك انتقالية عشوائية حركة انتقالية وتذبذبية شكل (٥ - ١ ) الحركة البراونية ج - جزيئات جسم صلب تتحرك حركة تذبذبية فقط إذا فحصنا دخاناً متصاعداً من شمعة بواسطة الميكروسكوب لوجدنا دقائق الكربون المكونة للدخان تتحرك هنا وهناك حركات عشوائية، وحركة دقائق الكربون هذه تعرف بالحركة البراونية، إذ كان براون Brown عالم نبات اسكتلندى أول من اكتشف عام ۱۸۲۷م أن حبوب اللقاح المعلقة في الماء تكون دائماً في حركة عشوائية. تفسير الحركة البراونية تتحرك جزيئات الهواء ) أو أى غاز ) بسرعات مختلفة وفي جميع الإتجاهات بطريقة عشوائية. وأثناء حركتها تلك تصطدم مع بعضها البعض، كما تصطدم مع دقائق الكربون المكونة للدخان. وعندما يكون عدد التصادمات مع أحد جوانب دقيقة الكربون في لحظة معينة اكبر من عدد التصادمات مع الجانب المقابل، فإن دقيقة الكربون سوف تتحرك في اتجاه معين لمسافة قصيرة. والسبب فى ذلك أن جزيئات الغاز - بعكس المواد الصلبة - حرة الحركة ، ودائمة التصادم ، فتغير اتجاها عشوائيا بفعل الحرارة (شكل ١٥) مطابع زمزم 19 الفيزياء الصف الثانى الثانوى |
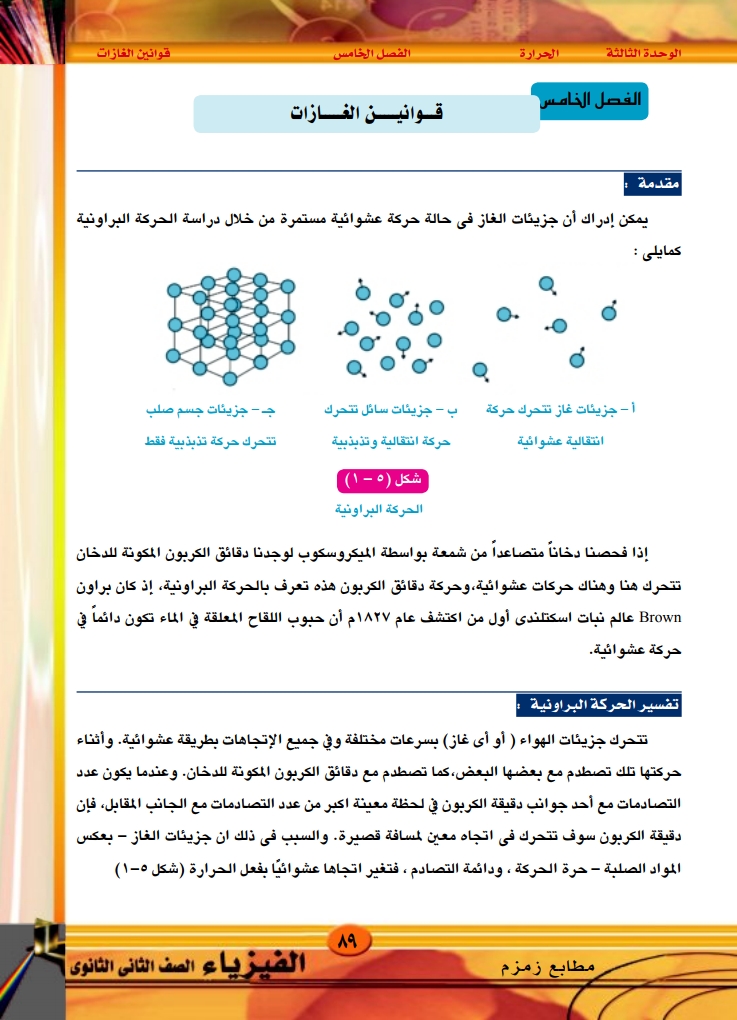
الوحدة الثالثة الحرارة الفصل الخامس قوانين الغازات ويمكن أن نستخلص من ذلك مايلي : جزيئات الغاز في حالة حركة عشوائية مستمرة، وأثناء حركتها تتصادم مع بعضها البعض كما تتصادم مع جدران الإناء الذي يحتويها. غاز نشادر ورقة إنتشار سحب بيضاء من كلوريد الأمونيوم سحب كلوريد الأمونيوم يلا الخيارين IF[EE تسحب الورقة غاز كلوريد هيدروجين شكل ( ٥ - ٢) توضيح وجود المسافات البينية بين جزيئات الغاز - ويمكن إدراك وجود مسافات فاصلة بين جزيئات الغاز تعرف بالمسافات الجزيئية كما يلي: إذا أخذنا مخباراً مليئاً بغاز النشادر ونكسناه فوق مخبار آخر مليء بغاز كلوريد الهيدروجين شكل ٢٥)، عندئذ سنشاهد تكون سحابة بيضاء من كلوريد الأمونيوم تأخذ في النمو والانتشار حتى تملأ كل حيز المخبارين. يفسر ما حدث بأن جزيئات غاز كلوريد الهيدروجين - رغم كونه أكبر كثافة - تنتشر إلى أعلى متخللة مسافات فاصلة بين جزيئات غاز النشادر، حيث تتحد مع جزيئاته مكونه كلوريد الأمونيوم الذي تنتشر جزيئاته لتملأ المخبار العلوى . كما تنتشر جزيئات النشادر رغم كونه أقل كثافة إلى أسفل خلال المسافات الفاصلة بين جزيئات غاز كلوريد الهيدروجين، حيث تتحد مع جزيئاته مكونة كلوريد الأمونيوم الذي تنتشر جزيئاته لتملأ المخبار السفلي. ومما سبق نستخلص أن جزيئات الغاز بينها مسافات فاصلة كبيرة نسبيًا تعرف بالمسافات الجزيئية. ويؤكد هذا قابلية الغازات للانضغاط، حيث تسمح المسافات الجزيئية الكبيرة نسبيًا بتقارب جزيئات الغاز عند تعرضها للضغط، فيقل الحجم الذي يشغله الغاز. الفيزياء الصف الثانى الثانوى ۲۰۲۰ - ۲۰۱۹

الوحدة الثالثة الحرارة الفصل الخامس قوانين الغازات قوانين الغازات أصبح من المؤكد أن التجارب التي تجرى لقياس التمدد الحراري لغاز ما معقدة لأن حجم الغاز يمكن أن يتغير بتغير كل من الضغط أو درجة الحرارة أو كليهما، مثل هذه الصعوبة لا تظهر في حالة الجوامد أو السوائل لأن قابليتها للانضغاط صغيرة جداً ويمكن إهمالها. ولإجراء دراسة تامة حول سلوك غاز ما ينبغي أن نأخذ في الاعتبار وجود ثلاثة متغيرات هي الحجم والضغط ودرجة الحرارة. لذلك توجد ثلاث تجارب منفصلة، كل منها تستخدم لدراسة العلاقة بين متغيرين فقط مع تثبيت المتغير الثالث هذه التجارب هي : 1 - العلاقة بين حجم الغاز وضغطه عند ثبوت درجة حرارته قانون بويل). ٢ - العلاقة بين حجم الغاز ودرجة حرارته عند ثبوت ضغطه قانون شارل). - العلاقة بين ضغط الغاز ودرجة حرارته عند ثبوت حجمه (قانون الضغط أو قانون جولى). وسنتناول فيمايلى دراسة كل من العلاقات الثلاث. A B B B A شكل ( ٥ - ٣) جهاز بویل أولا : العلاقة بين حجم الغاز وضغطه عند ثبوت درجة حرارته قانون بويل) - لدراسة العلاقة بين حجم مقدار معين من الغاز وضغطه عند ثبوت درجة حرارته، يستخدم الجهاز الموضح في الشكل (٥) (۳) ويتكون من أنبوبة زجاجية (A) تشبه سحاحة مقلوبة يبدأ تدريجها من أعلى تتصل الأنبوبة (A) بأنبوبة أخرى (B) من الزجاج بواسطة أنبوبة من المطاط، وتحتوي الأنبوبتان على كمية مناسبة من الزئبق. ويحمل الأنبوبتين قائم رأسي مثبت على قاعدة أفقية ترتكز على ثلاثة مسامير محواة يمكن بواسطتها جعل القائم رأسيًا تماما . والأنبوبة (B) قابلة للحركة على طول القائم الرأسى إلى أعلى أو إلى أسفل ويمكن تثبيتها في أي موضع. مطابع زمزم ۹۱ الفيزياء الصف الثانى الثانوى |

الوحدة الثالثة الحرارة الفصل الخامس قوانين الغازات وتتبع الخطوات الآتية: 1 – نفتح صنبور الأنبوبة (A) مع تحريك الأنبوبة (B) إلى أعلى أو أسفل حتى يصبح سطح الزئبق في الأنبوبة (A) عند منتصفها (شكل ٥ ٣ أ) ونظرا لأن الأنبوبتين مفتوحتان يكون سطحا الزئبق فيهما في مستوى أفقى واحد. ۲ - نغلق صنبور الأنبوبة (A) ونقيس حجم الهواء المحبوس وليكون ( ( (Va) وضغطه وليكن يساوى الضغط الجوى P cmHg الذي نعينه بواسطة البارومتر. 3 - نحرك الأنبوبة (B) إلى أعلى مسافة مناسبة عدة سنتيمترات)، وعندئذ نقيس حجم الهواء المحبوس وليكن (V) ، ونقيس فرق الارتفاع بين سطحى الزئبق في الأنبوبتين وليكن h . وعندئذ يكون ضغط الهواء المحبوس هو P2P + h (شكل ٥ - ( ب ). 4 – تكرر الخطوة السابقة مرة أخرى على الأقل بتحريك الأنبوبة (B) إلى أعلى مسافة مناسبة أخرى ونعين V) ، P3) بنفس الكيفية. ه – نحرك الأنبوبة (B) إلى أسفل حتى يصبح سطح الزئبق فى الأنبوبة (B) أقل من سطح الزئبق في الأنبوبة (A) بعدة سنتيمترات وعندئذ نقيس حجم الهواء المحبوس وليكن (V) وضغطه P هو PP-h ، حيث h فرق الارتفاع بين سطحى الزئبق في الأنبوبتين (شكل ٥ - ٣ جـ) - نكرر الخطوة السابقة مرة أخرى على الأقل بتحريك الأنبوبة (B) إلى أسفل مسافة أخرى ونوجد Vas ، Ps) بنفس الكيفية. - نرسم علاقة بيانية بين حجم الغاز 7 ممثلا على المحور 1 الرأسى ومقلوب الضغط ( 5 ) ممثلا على المحور الأفقى نحصل على خط مستقيم كما في الشكل (٥ - ٤) ومن هذه العلاقة البيانية نتبين أن Vol 금 ومن هذه العلاقة يكون : حجم مقدار معين من غاز يتناسب تناسبا عكسيًا مع ضغطه عند ثبوت درجة حرارته وهذا هو نص قانون بويل الفيزياء الصف الثانى الثانوى شكل ( ٥ - (٤) العلاقة بين حجم الغاز ومقلوب الضغط ۹۲ ۲۰۲۰ - ۲۰۱۹

الوحدة الثالثة الحرارة الفصل الخامس ويمكن صياغة قانون بويل بكيفية أخرى حيث يكون const P P Vol = const (5-1) قوانين الغازات Vol أي أن: عند ثبوت درجة الحرارة يكون حاصل الضرب PVol لكمية معينة من غاز مقدارا ثابتًا. 01 أثر الحرارة في حجم الغاز عند ثبوت ضغطه نعلم أن الغازات تتمدد بالحرارة وتنكمش بالبرودة. ولكن هل تتمدد الحجوم المتساوية من الغازات المختلفة وهي تحت ضغط ثابت بمقادير مختلفة، أم بمقادير متساوية؟ لإدراك ذلك نجرى التجربة الآتية: تماماً 1- نأخذ دورقين متساويين في الحجم وفوهة كل منهما مسدودة بسدادة تنفذ منه أنبوبة زجاجية منثنية على زاوية قائمة بها زئبق على شكل خيط طوله 2cm أو 3cm ، شكل ( ٥ - ٥) CO₂ أثر الحرارة في حجم الغاز مع ثبوت الضغط وليكن أحدهما مملوءًا بالأكسجين والآخر مملوءًا بالهواء أو ثانى أكسيد الكربون ثم اغمرهما في حوض به ماء كما في شكل ( ٥ - ٥ ) . ٢- أضف إلى ماء الحوض قليلاً من الماء الساخن ولاحظ مقدار المسافة التي يتحركها خيط الزئبق في كل منهما. نلاحظ أن خيطى الزئبق يتحركان مسافتين متساويتين مما يدل على أن الحجوم المتساوية من الغازات المختلفة تتمدد بمقادير متساوية إذا ارتفعت درجة حرارتها بنفس المقدار مع ثبوت ضغطها ومن ثم نتوقع أن يكون معامل التمدد الحجمي لها واحدا. معامل التمدد لغاز تحت ضغط ثابت « هو مقدار الزيادة في وحدة الحجوم من الغاز وهى فى درجة 0°C إذا ارتفعت درجة حرارتها درجة واحدة مئوية مع بقاء ضغطها ثابتا « ويرمز لها بالرمز (a) مطابع زمزم ۹۳ الفيزياء الصف الثانى الثانوى |
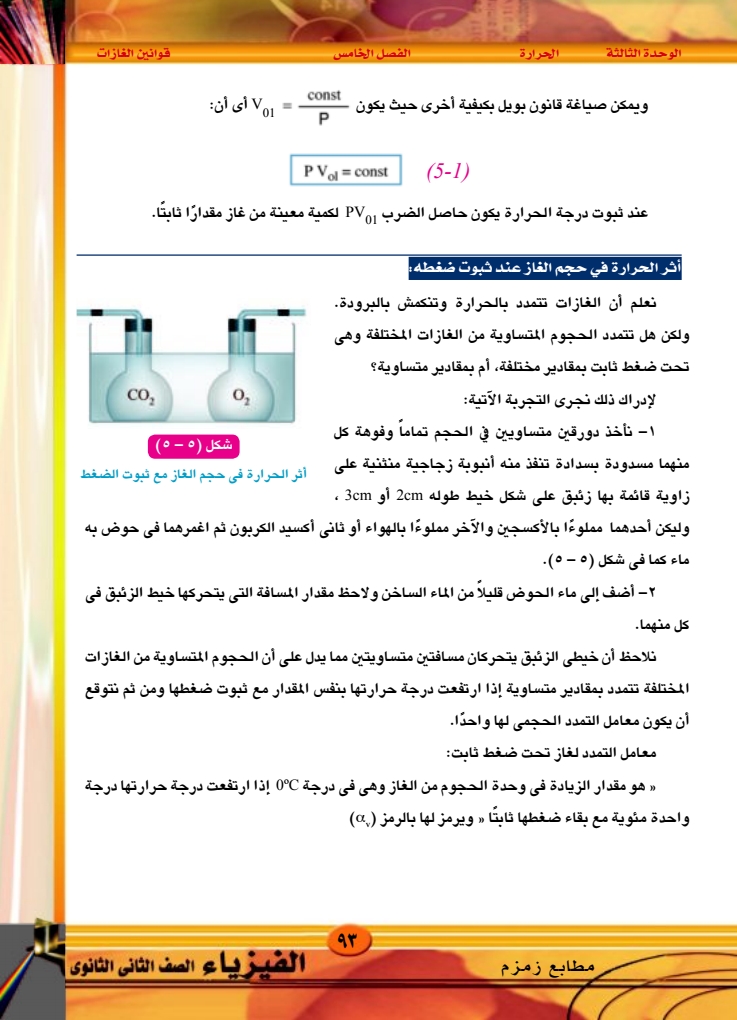
الوحدة الثالثة الحرارة الفصل الخامس ثانيا : العلاقة بين حجم الغاز ودرجة حرارته عند ثبوت ضغطه (قانون) شارل) لدراسة العلاقة بين حجم الغاز ودرجة حرارته ثبوت ضغطه يستخدم جهاز شارل المبين بالشكل ٥ - ٦ أ ) ، ويتركب إناء إسطواني من أنبوبة زجاجية طولها 30cm وقطرها حوالي 1mm مقفلة من أحد طرفيها بها قطرة من الزئبق تحبس كمية من الهواء داخل الأنبوبة ، والأنبوبة مثبتة مع ترمومتر على مسطرة من الزجاج مفتوح الطرفين مدرجة داخل إناء أسطواني من الزجاج وتتبع الخطوات سدادة من المطاط . أنبوبة . الخروج بخار الماء الآتية: 1 - يوضع الجهاز السابق داخل غلاف من الزجاج ويملأ الغلاف بجليد مجروش أخذ في الانصهار ويترك فترة مناسبة حتى يبرد الهواء داخل الأنبوبة إلى 0°C. قوانين الغازات ح أنبوبة الدخول بخار الماء ي قطرة من الزئبق ح أنبوبة شعرية شكل ( ٥ - ٦ ) جهاز شارل -273°C B Vol Noot toc tooc شكل ٥ - ٦ (ب) قانون شارل علاقة الحجم بدرجة الحرارة عند ثبوت الضغط ٢ – يقاس طول عمود الهواء المحبوس الذي يتخذ مقياسا لحجمه V)gee) نظرا لأن الأنبوبة منتظمة ٩٤ ۲۰۲۰ - ۲۰۱۹ المقطع . الفيزياء الصف الثانى الثانوى
الوحدة الثالثة الحرارة الفصل الخامس قوانين الغازات ٣ - يفرغ الغلاف من الجليد والماء ، ثم يمرر بخار ماء فى الغلاف من أعلى إلى أسفل مع الانتظار مدة مناسبة حتى تصبح درجة حرارة الهواء المحبوس 100°C ويقاس طول عمود الهواء المحبوس ، ويتخذ مقياسًا لحجمه وليكن 1000 (01) - ترسم علاقة بين الحجم Vol ودرجة الحرارة شكل ٥ - ٦ (ب) نجد أن هذه العلاقة خط مستقيم وإذا مددنا هذا الخط ، فإنه يقطع المحور الأفقى عند قيمة 273°C ه - يعين معامل التمدد الحجمي للهواء عند ثبوت ضغطه من العلاقة (5-2) (Vol) 100°C. (Volo'c |ay = (VolocX 100°C وقد وجد عمليا أن معامل التمدد الحجمي للهواء a يساوى 273 لكل درجة ، ونظرا لأن الحجوم المتساوية من الغازات المختلفة تتمدد تحت ضغط ثابت بمقادير متساوية يكون لمعامل التمدد الحجمى للغازات المختلفة نفس القيمة . هذه النتيجة صاغها شارل كما يلى: قانون شارل عند ثبوت الضغط يزداد حجم كمية من غاز بمقدار من حجمها الأصلى عند 0°C لكل ارتفاع في 1 273 درجة الحرارة مقداره درجة واحدة ولا تختلف هذه القيمة من غاز لآخر. أثر الحرارة فى ضغط الغاز عند ثبوت حجمه : 1 – لدراسة تأثير الحرارة على ضغط غاز ما عند ثبوت حجمه ، نأخذ دورقًا زجاجيا مسدودا بسدادة تنفذ منها أنبوبة ذات شعبتين (A) ، (B) كالمبينة فى شكل (٥) - (۷) نلاحظ أن الأنبوبة تحتوى على كمية مناسبة من الزئبق يستقر سطحاه في الشعبتين (A) ، (B) فى مستوى أفقى واحد عند (Y) ، (X) لذلك يكون ضغط الهواء المحبوس فى الدورق مساويًا للضغط الجوى ثم نعين درجة حرارة الهواء ولتكن t°C شكل ( ٥ - ١٧) مطابع زمزم ۹۵ الفيزياء الصف الثانى الثانوى |

الوحدة الثالثة الحرارة الفصل الخامس قوانين الغازات هواء (1) (ب) شكل ( ٥ - ٧) اثر الحرارة علي الضغط عند ثبوت الحجم. (جـ) ٢ - نغمر الدورق في حوض به ماء دافئ درجة حرارته t °C نلاحظ أن سطح الزئبق يبدأ في الانخفاض في الشعبة (A) ، بينما يرتفع فى الشعبة (B) (شكل ٥ - ٧ ب) - نصب زئبقا في القمع حتى يعود سطح الزئبق في الشعبة (A) إلى العلامة (X) حتى يتساوى حجم الهواء المحبوس في الدورق وهو فى (t, °C) مع حجمه وهو في (t°C) ٤ - نلاحظ أن سطح الزئبق فى الشعبة (B) يعلو عن سطحه في (A) بمقدار معين وليكن (h(cm مما يدل على أن ضغط الهواء المحبوس قد ازداد نتيجة لارتفاع درحة الحرارة من C إلى t°C بمقدار يساوى (cm Hg) (شكل ٥ - جـ). ه - وإذا أجرينا التجربة السابقة عدة مرات مع ملء الدورق بغاز مختلف في كل مرة وتم تعيين مقدار الزيادة في ضغط الغاز مع ثبوت حجمه بارتفاع درجة الحرارة لنفس المقدار فإننا نتبين مايلي : ۱ - عند ثبوت حجم الغاز يزداد ضغطه بارتفاع درجة الحرارة. ۲ - عند ثبوت الحجم تزداد الضغوط المتساوية للغازات المختلفة بنفس المقدار إذا ارتفعت درجة حراراتها بمقادير متساوية . معامل الزيادة فى الضغط هو مقدار الزيادة فى وحدة الضغط المقاسة عند درجة 0°C إذا رفعت درجة حرارتها درجة واحدة عند ثبوت الحجم. الفيزياء الصف الثانى الثانوى 97 ۲۰۲۰ - ۲۰۱۹

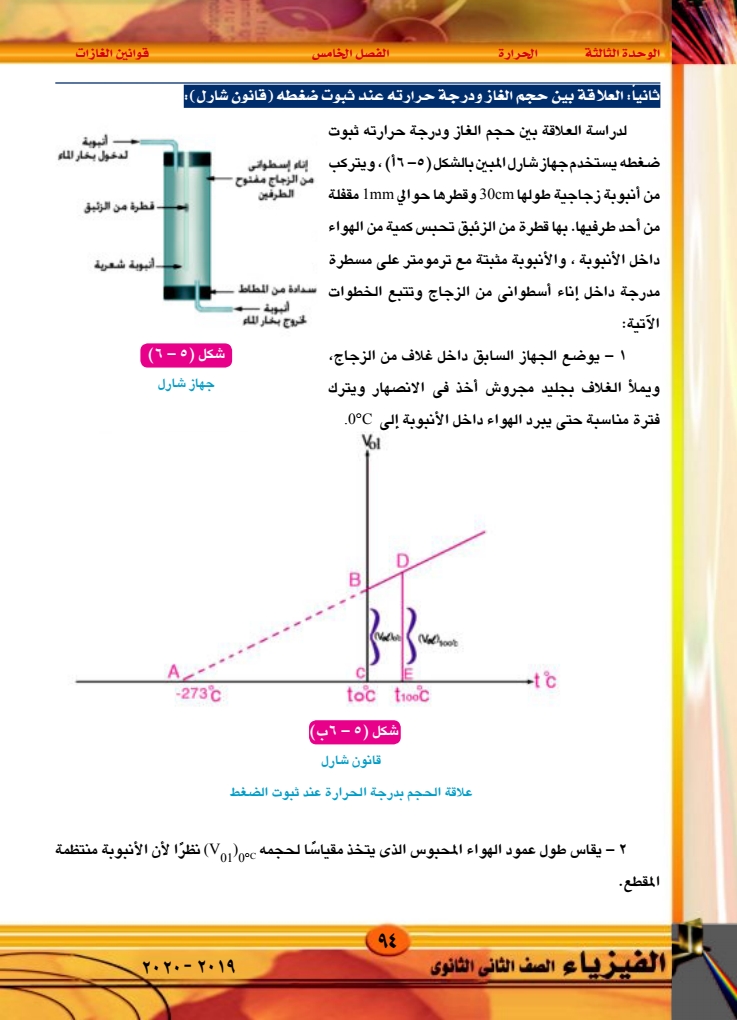
الوحدة الثالثة الحرارة الفصل الخامس قوانين الغازات ثالثا : العلاقة بين ضغط الغاز ودرجة حرارته عند ثبوت حجمه (قانون الضغط وجد عمليا أن الزيادة فى ضغط الغاز تتناسب طرديًا مع الضغط الأصلى المقاس عند درجة (PC) 0°C وكذلك مع الارتفاع في درجة حرارته At°C . ويعبر عن هذا كمايلي: AP ∞ Po'c At ˚C AP = Bp Poc At °C Bp AP PeciArc (5-3) حيث Bp مقدار ثابت وهو زيادة ضغط الغاز مع درجة حرارته عند ثبوت حجمه. C B X ج ترمومتر شكل ( ٥ - (۸) جهاز جولی زئبق ولتعيين معامل زيادة ضغط الغاز عند ثبوت حجمه يستخدم جهاز جولى الموضح في الشكل (٥-٨) ويتركب من مستودع كروى (A) من الزجاج رقيق الجدران، يتصل بأنبوبة شعرية (B) طويلة ومنثنية على شكل زاويتين قائمتين ، وهو مثبت على لوحة رأسية مثبتة بدورها على قاعدة أفقية ترتكز على ثلاثة مسامير محواة. ويتصل طرف الأنبوبة الشعرية (B) بواسطة انبوبة من المطاط بأنبوبة متسعة نوعا ما مطابع زمزم ۹۷ الفيزياء الصف الثانى الثانوى |
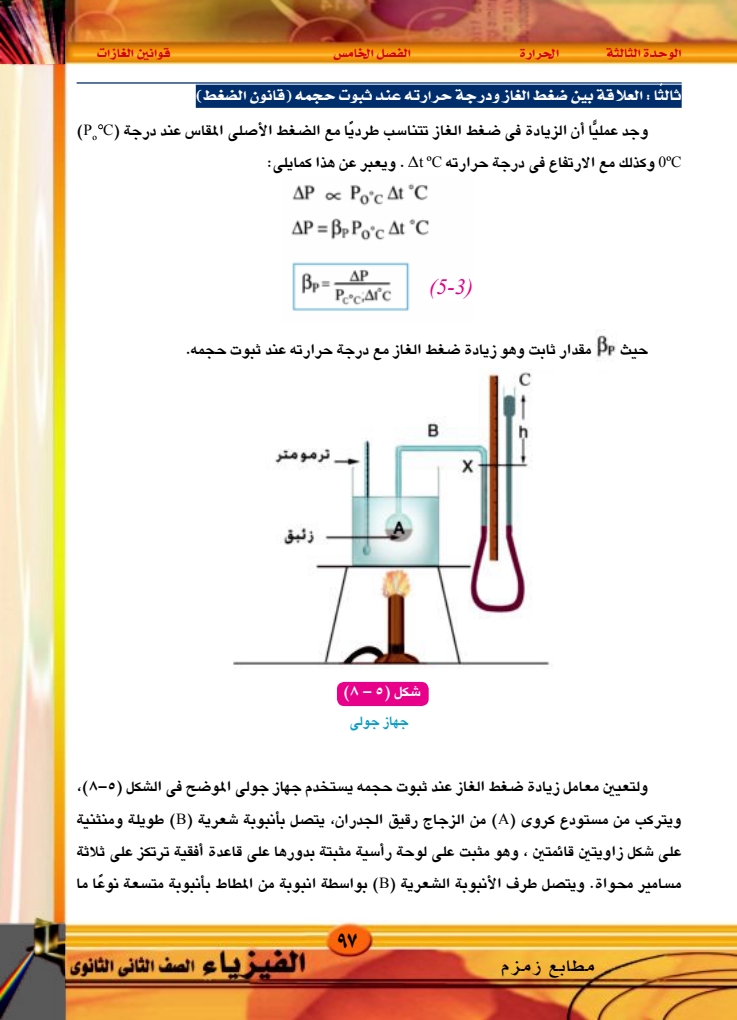
الوحدة الثالثة الحرارة الفصل الخامس قوانين الغازات وهي الأنبوبة (C) والأنبوبة (C) قابلة للحركة إلى أعلى أو إلى أسفل على اللوحة الرأسية وتوجد مسطرة مدرجة مثبتة على هذه اللوحة. وتتبع خطوات العمل الآتية : ۱ - نعين الضغط الجوى وقت التجربة باستخدام البارومتر ۲ – ندخل في المستودع (۸) – . حجمه زئبقا ليظل حجم الجزء المتبقى منه ثابتا في جميع درجات الحرارة (حيث أن معامل التمدد الحجمي للزئبق سبع أمثال معامل التمدد الحجمي للزجاج). - نغمر المستودع (A) فى كأس به ماء ثم نصب زئبقا في الفرع الخالص (C) حتى يرتفع سطحه في الفرع الآخر إلى علامة معينة (X) - نسخن الماء فى الكأس حتى يغلى وننتظر مدة مناسبة حتى تثبت درجة الحرارة ويقف انخفاض سطح الزئبق في الفرع المتصل بالمستودع. ه - نحرك الفرع الخالص (C) إلى أعلى حتى يرتفع سطح الزئبق فى الفرع الآخر إلى نفس العلامة (X) ثم نقيس الفرق فى الارتفاع بين سطحى الزئبق في الفرعين وليكن (h) ومن ذلك نحدد ضغط الهواء المحبوس وليكن (P) وهو يساوى الضغط الجوى (cm) مضافا إليه الفرق في الارتفاع (h) ٦ - نحرك الفرع (C) إلى اسفل ثم نوقف التسخين ونترك المستودع لتنخفض درجة حرارته إلى حوالى 90°C ، ثم نحرك الفرع (C) إلى أعلى حتى يرتفع سطح الزئبق فى الفرع المتصل بالمستودع إلى العلامة (X) ثم نعين درجة الحرارة وفرق الارتفاع بين سطحى الزئبق في الفرعين ومن ذلك نحسب ضغط الهواء المحبوس في هذه الحالة. - نكرر العمل السابق عدة مرات عند درجات حرارة مختلفة وفى كل مرة نحسب ضغط الهواء المحبوس بنفس الكيفية السابقة. 8 – نرسم علاقة بيانية بين درجات الحرارة ممثلة على المحور الأفقى والضغط ممثلا على المحور الرأسى نجد أن العلاقة خط مستقيم، ثم نحسب معامل الزيادة في ضغط الغاز عند ثبوت حجمه من العلاقة : P = P100°C Po°C Pocx 100 ۹۸ ۲۰۲۰ - ۲۰۱۹ (5-4) الفيزياء الصف الثانى الثانوى

الوحدة الثالثة الحرارة الفصل الخامس قوانين الغازات وقد وجد عمليا أن معامل زيادة ضغط الهواء عند ثبوت حجمه يساوى - لكل ارتفاع في درجة 1 273 الحرارة مقداره درجة واحدة . ولقد وجد أن معامل زيادة ضغط الغازات المختلفة عند ثبوت حجومها يكون له نفس القيمة. ويمكن من نتائج التجربة السابقة أن نتوصل إلى مايلي : عند ثبوت الحجم يزداد ضغط كمية معينة من غاز بمقدار من ضغطه في صفر سلزيوس لكل 1 273 ارتفاع في درجة الحرارة مقداره درجة واحدة . وهذا هو قانون الضغط. الصفر المطلق ( صفر كلفن ) : باستخدام الجهاز المبين بشكل (٥) - ٧) لقياس حجم الهواء المحبوس في درجات حرارة مختلفة. يمكننا رسم علاقة بيانية بين الحجم ممثلا على المحور الرأسى ودرجة الحرارة مقاسة على تدريج سلزيوس ممثلة على المحور الأفقى، نحصل على خط مستقيم كما في الشكل (٥) - (۹) نمد هذا الخط المستقيم على استقامته نجد أنه يقطع محور درجات الحرارة عند ( 273°C-) (M) ot B (Valor EL 50 100 150 200 مطابع زمزم toc t شكل ( ٥ - ٩) استنتاج الصفر كلفن من قانون شارل ٩٩ A-273 الفيزياء الصف الثانى الثانوى |

تابع قانون الضغط2
الوحدة الثالثة الحرارة الفصل الخامس قوانين الغازات كما يمكن الاستعانة بالنتائج التي حصلنا عليها في تجربة جهاز جولى وتمثيل هذه النتائج بيانيا ، حيث تمثل الضغط على المحور الرأسى وتمثل درجة الحرارة مقاسة على تدريج سلزيوس على المحور الأفقى ، عندئذ يتم الحصول على خط مستقيم كما في الشكل ( ٥ - ١٠) وعند مد هذا الخط المستقيم على استقامته يلاحظ أنه يقطع محور درجة الحرارة هو الآخر (273°C) Pest tc toc tec A -273 شكل ( ٥ - ١٠ ) استنتاج الصفر المطلق من تجربة جولى من الشكلين ( (٥ - (۹) و (٥ - (۱۰) تكون أقل درجة حرارة يمكن الوصول إليها نظريًا. هي 273°C- هذه الدرجة تقابل ما يسمى الصفر المطلق أو صفر كلفن وهى درجة الحرارة التي ينعدم عندها حجم وضغط الغاز المثالي ، ودرجة الحرارة على مقياس كلفن قيمة موجبة دائمًا بينما درجة سلزيوس C° تتدرج بين الموجب والسالب. الفيزياء الصف الثانى الثانوى ۲۰۲۰ - ۲۰۱۹

الوحدة الثالثة الحرارة الفصل الخامس قوانين الغازات معلومة إثرائية الصفر المطلق يمكن إعادة رسم شكلى ٥ - ٩ ، ٥ - (١٠) بحيث يكون المحور الأفقى هو درجة الحرارة المطلقة. فيكون لدينا شكل ٥ - (۱۱) و شكل ٥ - (۱۲) ، يلاحظ أنه عند درجة الصفر كلفن فإن الحجم 0 = Vot والضغط (0=P)، ولكن فى الواقع فإنه مع التبريد الشديد لا تظل المادة بحالتها الغازية، بل تتحول إلى سائل وأحيانا صلب، ومن ثم لا تخضع لقوانين الغازات. ولذلك فإن تعريف الغاز المثالى هو الغاز الذي يتلاشى حجمه وضغطه عند درجة الصفر المطلق. ويلاحظ أننا أهملنا القوى بين الجزيئات وحجم تلك الجزيئات بالنسبة للإناء فى استنتاج قوانين الغاز المثالى وهو ما يسمى بالغاز الكامل. P OK (Va) Vol+ TK OK P P₁ TK (11-12) علاقة الحجم بدرجة الحرارة المطلقة عند ضغط ثابت (شكل ٦-١٢) علاقة الضغط بدرجة الحرارة المطلقة عند حجم ثابت ولإيجاد العلاقة بين تدريج سلزيوس وتدريج كلفن ناخذ في الاعتبار ما يلى (273°C) تقابل 0K 0°C يقابل 273K 100C تقابل 373K ای ان T('K) = 273 + 1(C) (5-5) مطابع زمزم الفيزياء الصف الثانى الثانوى

الوحدة الثالثة الحرارة الفصل الخامس قوانين الغازات صور أخرى لقانونى شارل وجولى (الضغط) 1 - يمكن الاستعانة بالشكل (٥) - (۹) فى الحصول على صيغة أخرى لقانون شارل. من تشابه المثلثين ADE ، ABC حيث : وبذلك يكون (Vol)1 (Vol)2 . (5-6) Ti T₂ BC = (Vol) DE = (Vol)2 AC = T, AE = T2 Vol «T Vol = const T عند ثبوت الضغط يتناسب حجم كمية معينة من غاز تناسبا طرديا مع درجة حرارته على تدريج كلفن. وهذه صيغة أخرى لقانون شارل. ٢- وبالاستعانة بالشكل (٥ - ١٠ ) وبنفس طريقة تشابه المثلثين يمكن الحصول على العلاقة: أي أن وبذلك يكون (5-7) == P, T 2 P T P = const T Po T عند ثبوت الحجم يتناسب ضغط كمية معينة من غاز تناسبا طرديا مع درجة حرارته على تدريج كلفن. وهذه صيغة أخرى لقانون الضغط. الفيزياء الصف الثانى الثانوى ١٠٢ ۲۰۲۰ - ۲۰۱۹

الوحدة الثالثة الحرارة الفصل الخامس قوانين الغازات القانون العام للغازات ذكرنا فيما سبق أن سلوك غاز ما يمكن وصفه بمتغيرات ثلاثة هي الحجم والضغط ودرجة الحرارة، والعلاقة التي تربط بين المتغيرات الثلاثة هى القانون العام للغازات. ويمكن استنتاج القانون العام للغازات كما يلى : أمثلة ثابتا ؟ الحل من قانون بويل من قانون شارل من ذلك نتبين أن: ومن هذه العلاقة أي أن: P عند ثبوت درجة الحرارة عند ثبوت الضغط عند ثبوت درجة الحرارة P T V. = const x P PV . Yal Const P P₁(Vol)₁ T₁ = P₂(Vol)2 T₂ (5-8) وهذا هو القانون العام للغازات 1- إذا كان حجم غاز في درجة صفر سلزيوس cm3 450 فما حجمه في 91°C بفرض أن ضغطه يظل (Vol)1 (Vol)2 T = T₂ 450 273 (Vol)2 273+91 (Vol)2= 450x364 273 = 600 cm3 مطابع زمزم الفيزياء الصف الثانى الثانوى |

أمثلة ص103 مثال 1/ فما حجمه 91 بفرض أن ضغطه يظل ثابتا
الوحدة الثالثة الحرارة الفصل الخامس قوانين الغازات ۲- سخن نصف لتر من الهيدروجين من 10°C إلى 293 فكم يكون حجمه بفرض أن ضغطه ثابت؟ (Vol)1 (Vol)2 = Ti T2 500 273+10 = (VOD)2 273+293 (Vol)2= 500x566 283 = 1000 cm3 = 1 liter 3- إذا كان ضغط غاز 26 هو 59.8cmHg فما ضغطه عند 130°C مع العلم بأنه ثابت الحجم؟ P = T PT 59.8 273+26 = P 273 +130 59.8 × 403 P, = =80.6 cmHg 299 الحل: الحل مقدار من غاز يشعل في درجة 27 وتحت ضغط 60mg حجما قدره cm3 380 فكم يكون حجمه عند معدل الضغط ودرجة الحرارة (S.T.P)؟ الحل: (S.T.P) معناه أنه تحت ضغط 76cmHg وفي درجة حرارة °C 0 أو K 273 (Vol)2= ۲۰۲۰ - ۲۰۱۹ P₁(Vol) Ti P₂(Vol)2 T2 60 X 380 300 = 60 X 380 X 273 76 X 300 76x (Vol)2 ١٠٤ 273 = 273 cm 3 الفيزياء الصف الثانى الثانوى

تابع أمثلة ص104 تمرين 2/ فكم يكون حجمه بفرض
3/ فما ضغطه عند 130 مع العلم بانه ثابت
4/ فكم يكون حجمه عند معدل الضغط
الوحدة الثالثة الحرارة الفصل الخامس قوانين الغازات ه مقدار من غاز النيتروجين حجمه liters 15 عندما يكون الضغط الواقع عليه cmHg 12 ومقدار من غاز الأكسجين حجمه liters 10 عندما يكون الضغط الواقع عليه 50cmHg وضعًا في إناء مقفل سعته liters 5، فإذا كانت درجة حرارة الغازين ثابتة أثناء خلطهما فأوجد ضغط مزيجهما. الحل كل من الغازين يشغل بهذا الخلط سعة الإناء أي liters 5 لإيجاد ضغط غاز النيتروجين بعد الخلط يطبق القانون P Vol = Pi (Vali .. 12 x 15 = P₁ x 5 P₁ = 36 cmHg لإيجاد ضغط غاز الأكسجين نطبق العلاقة PVol = P2 (Vol2 10 × 50 P, = 5 = 100 cm Hg وبما أن ضغط مخلوط غازين يساوى مجموع الضغطين الجزئيين لهما فإن ضغط مخلوط الغازين مطابع زمزم P = P + P2 = 36 + 100 = 136 cm Hg ۱۰۵ الفيزياء الصف الثانى الثانوى |

تابع أمثلة ص105 تمرين 5/ مأوجد ضغط مزيجهما
الوحدة الثالثة الحرارة الفصل الخامس قوانين الغازات (1) التعاريف والمفاهيم الأساسية تلخيص: • جزيئات الغاز في حالة حركة عشوائية مستمرة تتصادم مع بعضها البعض كما تتصادم مع جدران الإناء الذي يحتويها . توجد مسافات فاصلة بين جزئيات الغاز تعرف بالمسافات الجزيئية. . قانون بويل: عند ثبوت درجة الحرارة يتناسب حجم كمية معينة من غاز تناسبا عكسيًا مع ضغطها. • قانون شارل : عند ثبوت الضغط يزداد حجم مقدار معين من غاز بمقدار 273 من حجمه الأصلى عند 0°C لكل ارتفاع في درجة الحرارة مقدارها درجة واحدة أو يتناسب حجم كمية ثابتة من الغاز مع درجة الحرارة المطلقة تحت حجم ثابت • قانون الضغط (جولى) : عند ثبوت الحجم يزداد ضغط مقدار معين من غاز بمقدار 23 من ضغطه الأصلى عند 0°C لكل ارتفاع في درجة الحرارة مقداره درجة واحدة أو يتناسب ضغط كمية ثابتة من الغاز مع درجة الحرارة المطلقة تحت حجم ثابت • معامل زيادة الضغط بزيادة درجة الحرارة عند ثبوت الحجم = معامل زيادة الحجم بزيادة درجة الحرارة عند ثبوت الضغط = 23 لكل الغازات . درجة الحرارة المطلقة ( على مقياس كلفن) - درجة الحرارة على تدريج سلزيوس مضافًا إليها 273 - القوانين الهامة إذا كان Vo1 حجم كمية معينة من غاز ، P ضغطها Tدرجة حرارتها على مقياس كلفن فإن: . قانون بویل PVol = const عند ثبوت درجة الحرارة. 01 قانون شارل Yol = const عند ثبوت الضغط P T T . قانون الضغوط const = عند ثبوت الحجم. . القانون العام للغازات P1 (V01)1 T1 P2(01) 2 T2 أي أن const = • معامل ازدياد الحجم بازدياد درجة الحرارة عند ثبوت الضغط. Via - Voc Vocx Ate = لكل درجة 23 • معامل ازدياد الضغط بازدياد درجة الحرارة عند ثبوت الحجم. ١٠٦ ۲۰۲۰ - ۲۰۱۹ B.. Ptc-Po-c Po-cx Atoc = لكل درجة 2 الفيزياء الصف الثانى الثانوى

تلخيص











