المحاليل الحمضية والمحاليل القاعدية - العلوم 1 - ثاني متوسط
الدرس رابط الدرس الرقمي www.ien.edu.sa المحاليل الحمضية والمحاليل القاعدية في هذا الدرس الأهداف الأحماض تقارن بين خصائص الأحماض ما الذي يجعل طعم كل من عصير البرتقال والمخللات والحمضيات لاذعا؟ إن الأحماض الموجودة في هذه الأغذية وغيرها هي المسؤولة عن هذا الطعم. والقواعد. تصف الاستخدامات التطبيقية والأحماض Acids مواد تطلق أيونات الهيدروجين الموجبة "H في الماء، للأحماض والقواعد. ويتحد أيون الهيدروجين مع جزيء ماء لتكوين أيون الهيدرونيوم، كما في الشكل + توضح استخدامات مقياس ١٣ . وأيون الهيدرونيوم Hydronium Ion له شحنة موجبة، وصيغته "H3O. الرقم الهيدروجيني pH لوصف قوة الحمض أو القاعدة. تصف تفاعل الحمض مع الأهمية القاعدة. خصائص المحاليل الحمضية من خصائص المحاليل الحمضية الطعم اللاذع. وبه يتميز وجود الأحماض في الطعام. وعليك أن تحذر تذوق أي شيء في المختبر ؛ فالعديد من الأحماض تسبب حروقًا لأنسجة الجسم، وهي كاوية يمكنها إلحاق الضرر بالعديد من المواد، وتسبب تآكل الأقمشة والجلد والورق تعمل العديد من المنتجات - ومنها وغيرها. البطاريات والمواد القاصرة للألوان المزيلة للألوان) بسبب وجود الأحماض والقواعد فيها. مراجعة المفردات الخاصية الفيزيائية: أي صفة للمادة يمكن مشاهدتها أو قياسها دون تغيير للمادة. المفردات الجديدة . الحمض • الكاشف . أيون الهيدرونيوم . التعادل . القاعدة • الرقم الهيدروجيني pH ومحاليل الأحماض موصلة للكهرباء؛ إذ تستطيع أيونات الهيدرونيوم نقل الشحنات الكهربائية، ولهذا تستخدم الأحماض في بعض البطاريات. وتتفاعل محاليل بعض الأحماض بشدة مع أنواع من الفلزات، وينتج غاز الهيدروجين. + + H + H2O H3O أيون الهيدرونيوم جزيء ماء + + أيون الهيدروجين الشكل ١٣ يتحد أيون هيدروجين مع جزيء ماء لتكوين أيون الهيدرونيوم الموجب الشحنة. حدد ما أنواع المواد التي تمثل مصدرًا لأيونات الهيدروجين؟ ΕΛ وزارة التعليم Ministry of Education 2024-1446

الشكل ١٤ يحتوي كل من هذه المنتجات على حمض، أو صنع باستعمال حمض. صف كيف تكون الحياة مختلفة لو لم تتوافر الأحماض لصناعة هذه المواد؟ استخدامات الأحماض لعلك تعرف بعض الأحماض؛ فالخل المستخدم تجربة في الطعام يحتوي على حمض الإيثانويك والذي يعرف أيضًا بحمض الخليك ملاحظة التغيرات على مسمار أو الأسيتيك، وتحتوي الحمضيات - ومنها البرتقال والليمون – على حمض حديدي في مشروب غازي. الستريك، ويحتاج جسمك إلى حمض الأسكوربيك (فيتامين C)، بينما يحقن النمل ضحيته عند لسعها بحمض الفورميك حمض النمل). الخطوات ١ . لاحظ كيف يبدو المسمار في بداية التجربة. يظهر الشكل ١٤ منتجات صنعت باستخدام الأحماض؛ حيث يستخدم حمض الكبريتيك في صناعة الأسمدة والفولاذ والطلاء والبلاستيك، كما تستخدم ٢ . صبّ كمية كافية من المشروب الأحماض في البطاريات، ويطلق عليها أحيانًا بطاريات الأحماض. ويستخدم الغازي في كأس زجاجية. حمض الهيدروكلوريك في تنظيف الشوائب عن سطوح الأدوات الفلزية، . أسقط المسمار في الكأس ويستخدم حمض النيتريك في صناعة الأسمدة والبلاستيك والأصباغ. ولاحظ ما يحدث. ٤. دع المسمار في المشروب طوال الليل، وشاهده في اليوم التالي. الحمض في البيئة يلعب حمض الكربونيك دورًا أساسيا في تكوين الكهوف وتشكيل الهوابط والصواعد. يتكون حمض الكربونيك عندما يذوب ثاني أكسيد الكربون في الماء. ويذيب هذا المحلول الحمضي كربونات الكالسيوم التي تكون التحليل صخور الكهوف الجيرية . ويشبه هذا ما يحدث عندما يسقط المطر الحمضي على المواقع الأثرية، ويسبّب تآكل صخورها، كما يوضح الشكل ١٥ صفحة ٥٠ . ۱ . صف ما حدث عندما أسقط المسمار في المشروب الغازي، عندما تتساقط قطرات المحلول الحمضي من سقف كهف على أرضيته يتبخر وصف مظهر المسمار في اليوم الماء فتقلّ ذائبية ثاني أكسيد الكربون، ويتصاعد من المحلول، فتقل حموضة التالي. المحلول، ومن ثم تقل ذائبية الحجر الجيري، فيترسب الحجر الجيري، وتتشكل ٢ . فسر تفاعل المسمار مع المشروب الصواعد والهوابط. الغازي. وزارة التعليم ٤٩ Ministry of Education 2024-1446

المطر الحمضي الشكل ١٥ ينتج عن احتراق الوقود الأحفوري مركبات كيميائية متنوعة، تنطلق إلى الهواء الجوي. بعض هذه المركبات يكون أحماضًا تختلط ببخار الماء، ثم تهطل على سطح الأرض على هيئة مطر أو ثلج، أو ضباب، وتعمل على تدمير البيئة؛ حيث تقوم الرياح بحملها مئات الأميال، فتدمر الغابات ، وتس تآكل الصخور، وتشكل خطرًا على صحة الإنسان. يتفاعل ثاني أكسيد الكبريت وأكاسيد النيتروجين مع بخار الماء، فتتكون محاليل قوية الحمضية منها حمض النيتريك HNO3 وحمض الكبريتيك H2SO4 . أيُحرق الوقود الأحفوري في محطات الطاقة والسيارات للحصول على الطاقة الضرورية لممارسات الإنسان، وتتسبب عملية الاحتراق هذه في إطلاق ثاني أكسيد الكبريت SO2 وأكاسيد النيتروجين إلى الغلاف الجوي. ج يصل الرقم الهيدر جيني (pH) للمطر الحمضي في بعض المناطق إلى ما دون , ٢ وهذا الرقم يقارب درجة حموضة المعدة.

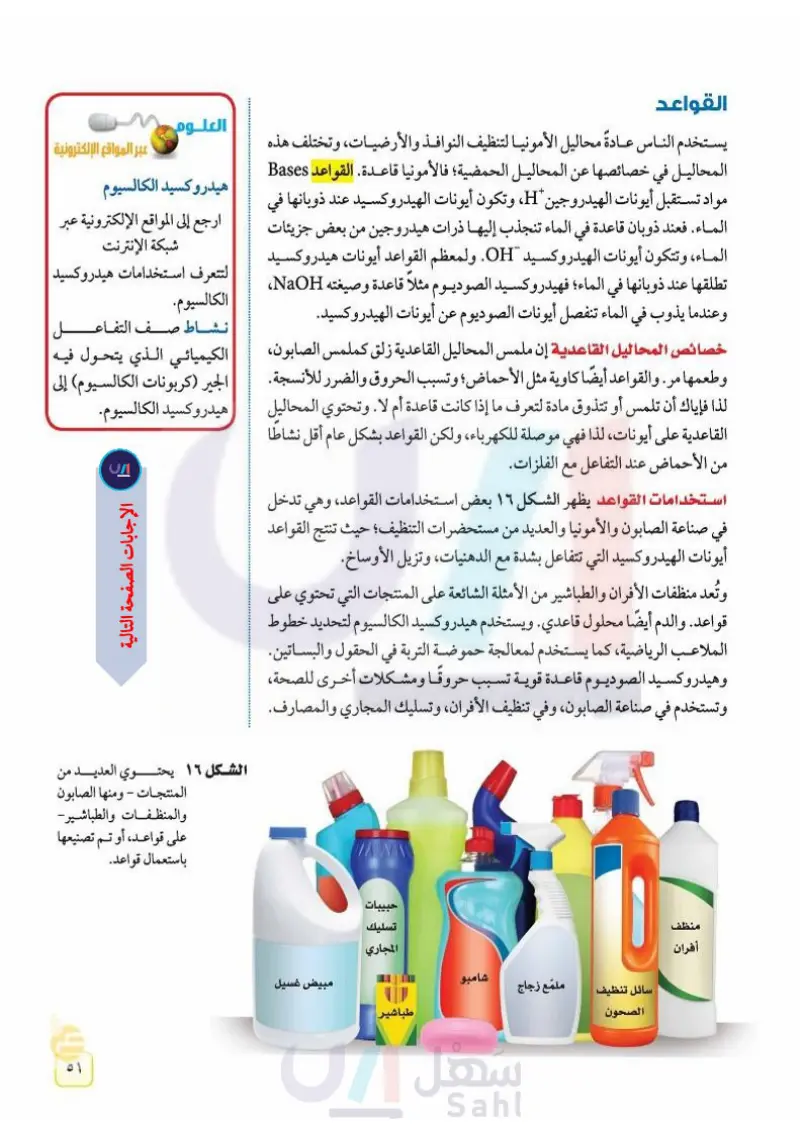
القواعد + العلوم عبر المواقع الإلكترونية هيدروكسيد الكالسيوم يستخدم الناس عادةً محاليل الأمونيا لتنظيف النوافذ والأرضيات، وتختلف هذه المحاليل في خصائصها عن المحاليل الحمضية؛ فالأمونيا قاعدة القواعد Bases مواد تستقبل أيونات الهيدروجين "H، وتكون أيونات الهيدروكسيد عند ذوبانها في الماء. فعند ذوبان قاعدة في الماء تنجذب إليها ذرات هيدروجين من بعض جزيئات ارجع إلى المواقع الإلكترونية الماء، وتتكون أيونات الهيدروكسيد OH. ولمعظم القواعد أيونات هيدروكسيد الموثوقة عبر شبكة الإنترنت لتتعرف استخدامات هیدروکسید تطلقها عند ذوبانها في الماء؛ فهيدروكسيد الصوديوم مثلا قاعدة وصيغته NaOH، وعندما يذوب في الماء تنفصل أيونات الصوديوم عن أيونات الهيدروكسيد. الكالسيوم. نشاط صف التفاعــــل خصائص المحاليل القاعدية إن ملمس المحاليل القاعدية زلق كملمس الصابون، الكيميائي الذي يتحول فيه وطعمها مر . والقواعد أيضًا كاوية مثل الأحماض ؛ وتسبب الحروق والضرر للأنسجة. الجير (كربونات الكالسيوم) إلى لذا فإياك أن تلمس أو تتذوق مادة لتعرف ما إذا كانت قاعدة أم لا. وتحتوي المحاليل هيدروكسيد الكالسيوم. القاعدية على أيونات، لذا فهي موصلة للكهرباء، ولكن القواعد بشكل عام أقل نشاطا من الأحماض عند التفاعل مع الفلزات. استخدامات القواعد يظهر الشكل ١٦ بعض استخدامات القواعد، وهي تدخل في صناعة الصابون والأمونيا والعديد من مستحضرات التنظيف؛ حيث تنتج القواعد أيونات الهيدروكسيد التي تتفاعل بشدة مع الدهنيات، وتزيل الأوساخ. وتُعد منظفات الأفران والطباشير من الأمثلة الشائعة على المنتجات التي تحتوي على قواعد. والدم أيضًا محلول قاعدي. ويستخدم هيدروكسيد الكالسيوم لتحديد خطوط الملاعب الرياضية، كما يستخدم لمعالجة حموضة التربة في الحقول والبساتين. وهيدروكسيد الصوديوم قاعدة قوية تسبب حروقا ومشكلات أخرى للصحة، وتستخدم في صناعة الصابون، وفي تنظيف الأفران ، وتسليك المجاري والمصارف. منظف أفران حبيبات تسليك المجاري شامبو مبيض غسيل سائل تنظيف ملمع زجاج طباشير الصحون الشكل ١٦ يحتـ العديد من المنتجات - ومنها الصابون والمنظفات والطباشير - على قواعد، أو تم تصنيعها باستعمال قواعد. وزارة التعليم Ministry of Education 2024-1446

الربط مع البيئة الرقم الهيدروجيني pH الرقم الهيدروجيني PH لعلك شاهدت أحد المختصين يقيس الرقم الهيدروجيني لماء الشرب في محطة لا تستطيع أغلب المخلوقات تحلية المياه الرقم الهيدروجيني pH مقياس لحمضية أو قاعدية المحلول، الحية العيش في الأوساط وتتدرج قِيَمُهُ بين صفر و ١٤. وتتدرّج قيم pH للمحاليل الحمضية بين صفر و ۷؛ الحمضية القوية. ومع ذلك فالمحاليل ذات الرقم الهيدروجيني الأقرب إلى صفر هي الأعلى حموضة، ومنها تحتاج بعض أنواع البكتيريا إلى حمض الهيدروكلوريك. أما الرقم ٧ فيعني التعادل؛ أي لا يكون المحلول حمضيا بيئة حمضية لتعيش وتتكاثر. ولا قاعديا، ومن ذلك الماء النقي. أما المحاليل ذات الرقم الهيدروجيني الأعلى وقد وجد في بعض ينابيع المياه من ٧ فتكون محاليل قاعدية. وتكون المحاليل ذات الرقم ١٤ هي الأعلى قاعدية، الحارة أنواع من البكتيريا تعيش ومنها محلول هيدروكسيد الصوديوم. ويظهر الشكل ١٧ الرقم الهيدروجيني لعدد في أوساط حمضية يتراوح رقمها الهيدروجيني بين ١ و ٣. من المواد الشائعة. ويرتبط الرقم الهيدروجيني pH مباشرة بتركيز أيونات الهيدرونيوم (HO) وأيونات الهيدروكسيد (OH). وتحوي المحاليل الحمضية أيونات هيدرونيوم أكثر من أيونات الهيدروكسيد. أما المحاليل القاعدية فتحوي أيونات الهيدروكسيد أكثر من أيونات الهيدرونيوم. وأما المحاليل المتعادلة فتحوي أعدادًا متساوية من كلا النوعين. ماذا قرأت؟ قارن عدد أيونات الهيدرونيوم بعدد أيونات الهيدروكسيد في المحلول المتعادل ؟ تدريج الرقم الهيدروجيني pH إن تدريج الرقم الهيدروجيني ليس تدريجا خطيا للقياس مثل الكتلة والحجم؛ حيث تكون كتلة جسم مثلا ضعف كتلة جسم آخر إذا كانت كتلة أحد الجسمين ٢ كجم وكتلة الآخر ١كجم. أما في تدريج الرقم الهيدروجيني فنقصان pH للحمض بمقدار درجة يعني أن الحمضية تزيد عشرة الشكل ١٧ يصنّف مقياس الرقم أضعاف. فإذا كان الرقم الهيدروجيني لحمض ۲ ولحمض ثان١ فلا يكون الحمض الهيدروجيني pH الثاني أكثر حمضية من الأول بمقدار الضعف، بل تكون حمضيته عشرة أمثال حمضية المواد إلى حمضية أو الأول. ولتحديد فرق قوة الحمضية استخدم العلاقة : ١٠ ؛ حيث (ن) الفرق بين قيم قاعدية أو متعادلة. pH. فالفرق بين قيمتي pH1 و pH3 هو ٢، إذن فرق الحمضية ١٠ ٢=١٠٠ مرة. ٥٢ الخل حمض الهيدروكلوريك محتويات المعدة بياض البيض حليب صودا الخبز 7654 3 2 1 هیدروكسيد الصوديوم الأمونيا 14 12 13 11 10 98 حليب المغنيسيا المشروبات الغازية > الطماطم بلازما الدم وزارة التعليم Ministry of Education 2024-1446

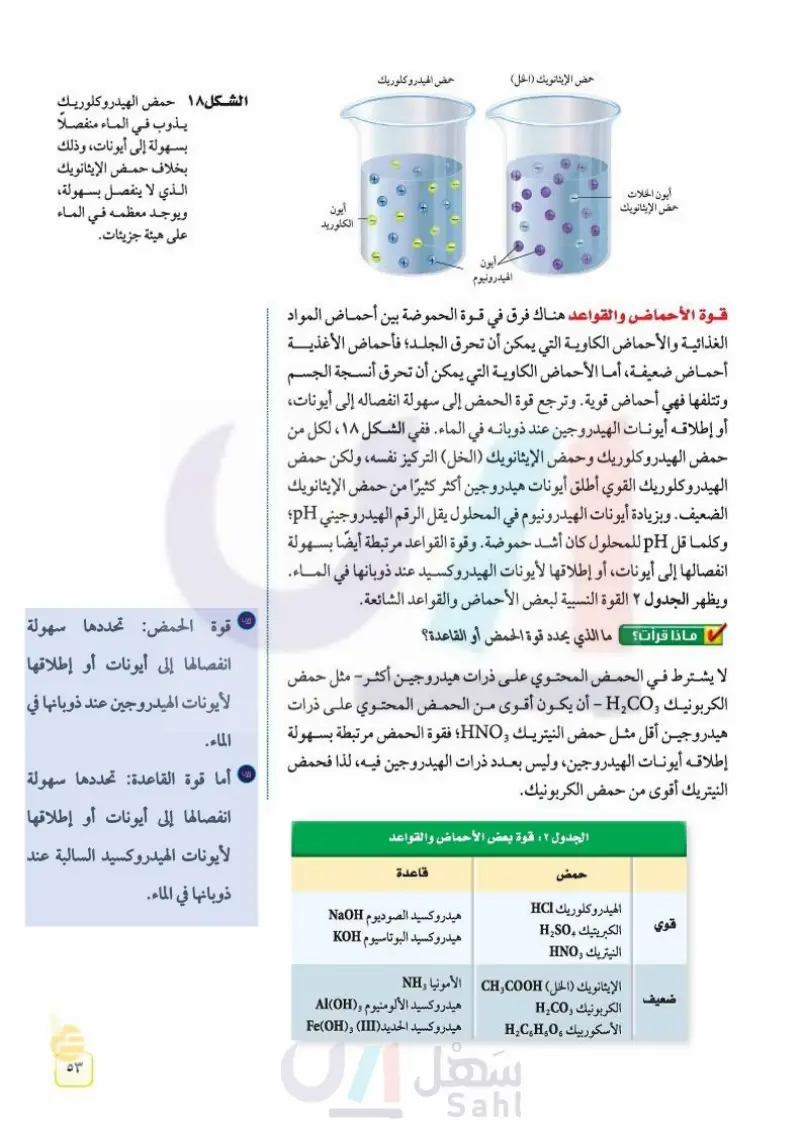
أيون الخلات حمض الإيثانويك حمض الإيثانويك (الخل) حمض الهيدروكلوريك أيون الكلوريد الشكل ١٨ حمض الهيدروكلوريك يذوب في الماء منفصلاً بسهولة إلى أيونات، وذلك بخلاف حمض الإيثانويك الذي لا ينفصل بسهولة، ويوجد معظمه في الماء على هيئة جزيئات. أيون الهيدرونيوم قوة الأحماض والقواعد هناك فرق في قوة الحموضة بين أحماض المواد الغذائية والأحماض الكاوية التي يمكن أن تحرق الجلد؛ فأحماض الأغذيــــــة أحماض ضعيفة، أما الأحماض الكاوية التي يمكن أن تحرق أنسجة الجسم وتتلفها فهي أحماض قوية. وترجع قوة الحمض إلى سهولة انفصاله إلى أيونات، أو إطلاقه أيونات الهيدروجين عند ذوبانه في الماء. ففي الشكل ١٨، لكل من حمض الهيدروكلوريك وحمض الإيثانويك (الخل) التركيز نفسه، ولكن حمض الهيدروكلوريك القوي أطلق أيونات هيدروجين أكثر كثيرًا من حمض الإيثانويك الضعيف. وبزيادة أيونات الهيدرونيوم في المحلول يقل الرقم الهيدروجيني pH؛ وكلما قل pH للمحلول كان أشد حموضة. وقوة القواعد مرتبطة أيضًا بسهولا انفصالها إلى أيونات، أو إطلاقها لأيونات الهيدروكسيد عند ذوبانها في المـــــــاء. ويظهر الجدول ٤ القوة النسبية لبعض الأحماض والقواعد الشائعة. ماذا قرأت ما الذي يحدد قوة الحمض أو القاعدة؟ لا يشترط في الحمض المحتوي على ذرات هيدروجين أكثر - مثل حمض الكربونيك و H2CO - أن يكون أقوى من الحمض المحتوي على ذرات هيدروجين أقل مثل حمض النيتريك و HNO؛ فقوة الحمض مرتبطة بسهولة إطلاقه أيونات الهيدروجين، وليس بعدد ذرات الهيدروجين فيه، لذا فحمض النيتريك أقوى من حمض الكربونيك. الجدول 4: قوة بعض الأحماض والقواعد حمض قاعدة الهيدروكلوريك HCI هیدروكسيد الصوديوم NaOH قوي الكبريتيك H2SO4 هیدروكسيد البوتاسيوم KOH النيتريك HNO3 الإيثانويك (الخل) CH3COOH الأمونيا NH3 ضعيف الكربونيك H2CO3 الأسكوربيك H2CHO هيدروكسيد الألومنيوم (OH) : هيدروكسيد الحديد (Fe(OH) (III Al(OH)3 ۵۳ وزارة التعليم Ministry of Education 2024-1446

العلوم الكواشف الكواشف ما الطريقة الآمنة لمعرفة حمضية محلول أو قاعديته ؟ الكواشف Indicators عبر المواقع الإلكترونية مركبات تتفاعل مع كل من المحاليل الحمضية والقاعدية وتعطي ألوانًا مختلفة بحسب قيمة الرقم الهيدروجيني pH للمحلول. وبعض الكواشف – ومنها ورق ارجع إلى المواقع الإلكترونية الموثوقة عبر شبكة الإنترنت تباع الشمس - تكون على هيئة أوراق. لتتعرف أنواع الكواشف. عند وضع ورقة تباع الشمس الزرقاء في محلول حمضي يتحول لونها إلى اللون نشاط صف كيف تعمل الأحمر. أما إذا وضعت ورقة تباع الشمس الحمراء في محلول قاعدي فيصبح النباتات كالكواشف في لونها أزرق. وتغير بعض الكواشف ألوانها ضمن مدى من قيم pH، فيظهر لون المحاليل الحمضية والمحاليل مختلف لكل قيمة من قيم الرقم الهيدروجيني. القاعدية؟ التعادل تسبب بعض الأطعمة - وبخاصة الكثيرة التوابل - حموضة للمعدة (الحرقة). وعندما تتناول أقراصًا مضادة للحموضة تشعر بتحسن. ما مضاد الحموضة؟ وكيف يعمل؟ تنتج آلام المعدة والجهاز الهضمي عن زيادة حمض الهيدروكلوريك في المعدة. ومع أن هذا الحمض يعمل على هضم الطعام إلا أن زيادته تؤدي إلى تهييج المعدة والقناة الهضمية، وحينئذ يلزم الشخص تناول أقراص مضادة للحموضة، وهي تُصنع عادة من هيدروكسيد الماغنسيوم (Mg(OH؛ حيث تعمل على معادلة الشكل ١٩ يكون pH للمحلول أقل الحمض الزائد والتعادل Neutralization هو تفاعل حمض مع قاعدة، ينتج یعنـي أكثر حمضية- نه ملح وماء. وقد سُمّي بذلك لأن الحمض والقاعدة يختفيان أو يتعادلان. عندما تكثر فيه كمية ويوضح الشكل ١٩ الكميات النسبية لكل من أيونات الهيدرونيوم وأيونات أيونات الهيدرونيوم. حدد ما الذي يجعل محلولاً الهيدروكسيد بين قيم صفر pH و ١٤ pH ٥٤ رقمه الهيـ متعادلا؟ دروجيني V ماذا قرأت ما نواتج تفاعل التعادل؟ صفر pH 7 H2O + HOR OHF OH 14 وزارة التعليم Ministry of Education 2024-1446

H30* OH 2H₂O الشكل ٢٠ عند تفاعل محلول حمضي مع آخر قاعدي تتفاعل أيونات الهيدرونيوم وأيونات الهيدروكسيد لتكوين الماء. أيون هيدرونيوم حدد لماذا يتغير الرقم الهيدروجيني pH للمحلول ؟ جزيئات ماء أيون هيدروكسيد كيف يحدث التعادل من المعلوم أن جزيء الماء يتكون من ذرتي هيدروجين وذرة أكسجين. ويظهر في الشكل ٢٠ أيون هيدرونيوم يتفاعل مع أيون هيدروكسيد لينتج جزيئان من الماء. ويحدث مثل هذا التفاعل عند تعادل حمض مع قاعدة؛ إذ تتفاعل أعداد متساوية من أيونات الهيدرونيوم وأيونات الهيدروكسيد لتكوين الماء. والرقم الهيدروجيني pH للماء النقي هو ۷؛ أي أن الماء النقي متعادل. ماذا قرأت ؟ ماذا يحدث لكل من الأحماض والقواعد خلال التعادل؟ مراجعة ٢ الدرس الخلاصة الأحماض والقواعد اختبر نفسك ١. حدد الأيونات التي تنتجها كل من الأحماض . الأحماض مواد تطلق أيونات الهيدروجين الموجبة والقواعد في الماء، واذكر خاصيتين لكل من في الماء. الأحماض والقواعد. القواعد مواد تستقبل أيونات الهيدروجين ٢. اذكر أسماء ثلاثة أحماض وثلاث قواعد، واكتب ( تطلق الهيدروكسيد) في الماء. المحاليل الحمضية والقاعدية موصلة للكهرباء. الرقم الهيدروجيني pH قائمة بالاستخدامات المنزلية أو الصناعية لكل منها. وضح ارتباط تركيز أيونات الهيدرونيوم وأيونات • الرقم الهيدروجيني pH مقياس لحمضية المحلول الهيدروكسيد بالرقم الهيدروجيني pH. أو قاعديته. . التفكير الناقد كيف يمكن لشركة تستخدم حمضًا يتراوح مدى الرقم الهيدروجيني pH بين صفر قويًا أن تعالج انسكابه على أرضية المصنع ؟ و ١٤ . التعادل التعادل تفاعل حمض مع قاعدة لإنتاج الملح والماء. • تطبيق الرياضيات ه. حل معادلة بخطوة واحدة كم تزيد حمضية محلول رقمه الهيدروجيني ٢ على محلول رقمه الهيدروجيني ٦ ؟ وكم تزيد قاعدية محلول رقمه الهيدروجيني ١٣ على آخر رقمه الهيدروجيني ١٠؟ وزارة التعليم Ministry of Education 2024-1446

استقصاء من واقع الحياة الأهداف تحدد الحمضية أو القاعدية نسبيًا لعدد من المحاليل الشائعة. قياس الرقم الهيدروجيني باستخدام الكواشف الطبيعية سؤال من واقع الحياة تعلمت أن الكواشف مواد يتغير لونها عندما يتغير الرقم الهيدروجيني pH. وعصير الملفوف البنفسجي كاشف طبيعي. كيف يمكن استخدام عصير الملفوف تقارن بين قوة الحمض وقوة البنفسجي في تحديد قيم pH نسبيًّا لعدد من المحاليل؟ وكيف تقارن بين قيم pH لمحاليل مختلفة؟ من المحاليل القاعدة لعدد من الحمضية والقاعدية. المواد والأدوات . ٩ أنابيب اختبار صغيرة. • حامل أنابيب اختبار. الخطوات ۱ ارسم جدولاً لتدوين أسماء المحاليل التي ستختبرها، والألوان التي يسببها إضافة كاشف عصير الملفوف البنفسجي إليها، والقوة النسبية للمحاليل. ٢. سجل على كل أنبوب اختبار اسم الحمض أو القاعدة الذي سيوضع فيه. عصير ملفوف بنفسجي مركز املأ الأنابيب إلى نصفها بالمحاليل التي ستختبرها . في علبة قطارة. تحذير: إذا انسكبت أي سوائل في منطقة العمل أو على جلدك فاغسلها بالماء حالا ، • قوارير عليها ملصق تحتوي وأخبر المعلم بذلك. على أمونيا منزلية، محلول صودا ٤. أضف عشر قطرات من كاشف عصير الملفوف إلى كل من المحاليل التي الخبز، محلول الصابون، محلول سيتم اختبارها. ورجّ كل أنبوب بلطف ليختلط عصير الملفوف بالمحلول. حمض الهيدروكلوريك بتركيز ۱٫۰ مول/ لتر، خل أبيض، شراب غازي غير ملون ماء مقطر. • قلم زيتي. ۹۰ قطارات. إجراءات السلامة CYCLE تحذير : الكثير من الأحماض والقواعد سامة وحارقة للجلد. البس النظارة الواقية والقفازين في جميع الأحوال. وأخبر معلمك حالا إذا انسكبت مادة، واغسل يديك بعد الانتهاء من التجربة. ه. لاحظ وسجل لون كل محلول في جدول البيانات. وزارة التعليم Ministry of Education 2024-1446

الأهداف
تحليل البيانات استخدام الطرائق العلمية مقياس الرقم الهيدروجيني pH ١. قارن ملاحظاتك بجدول مقياس الرقم الهيدروجيني pH الذي القوة النسبية للحمض تراه. ودوّن في جدول البيانات القوة النسبية للحمض أو القاعدة أو القاعدة لكل محلول تم اختباره. حمض قوي ۲. اعمل قائمة بالمحاليل مرتبة بحسب مقياس الرقم الهيدروجيني حمض متوسط القوة pH ابتداءً من أشدها حمضية وانتهاء بأشدها قاعدية. الاستنتاج والتطبيق ١. صنف المحاليل إلى حمضية أو قاعدية. حمض ضعیف محلول متعادل قاعدة ضعيفة ۲. حدد ما المحلول الذي كان الحمض فيه أضعف؟ وما قاعدة متوسطة القوة المحلول الذي كانت القاعدة فيه أقوى؟ وما المحلول الذي كان أقرب إلى التعادل؟ قاعدة قوية لون عصير الملفوف . توقع اعتمادًا على بياناتك، ما الأيون الذي يعمل على التنظيف في المحاليل: الأمونيا، الصابون، صودا الخبز ؟ تكوين فرضية كوّن فرضية تفسر لماذا كان محلول الصابون أقل قاعدية من محلول الأمونيا الذي له التركيز نفسه؟ تواصل ساناتك استعمل البيانات التي حصلت عليها من الاستقصاء في عمل ملصقات للمحاليل التي اختبرتها، واكتب القوة النسبية لكل محلول واكتب أي معلومة عن احتياطات السلامة تعتقد أنها مهمة على كل ملصق. ماء مقطر و سراب غازي ه خل ابيض محلول خوض هيدروكلوريا محلول صابون محلول صودا الخبر أمونيا ٥٧ زارت التي Education

ол أرقام قياسية في العلوم المحاليل المالحة هل تعلم... أن مياه البحر محلول ملحي؟ تمثل أيونات الصوديوم والماغنسيوم والكالسيوم والبوتاسيوم والكلوريد والكبريتات ٩٩% من أيونات الأملاح في البحر. وأكثر الغازات فيه النيتروجين والأكسجين وثاني أكسيد الكربون والأرجون والنيون. تشترك الدموع واللعاب في الكثير من الصفات فكلاهما محلول ملحي يؤدي إلى حمايتك من البكتيريا الضارة، ويحافظ على رطوبة الأنسجة، ويساعد على انتشار المواد المغذية. ويتكون اللعاب من الماء بنسبة %۹۹% والباقي % مجموعة من الأيونات تضم الصوديوم، والعديد من البروتينات. أكثر بحار العالم انخفاضًا وتركيزا البحر الميت في الأردن؛ حيث يقع في منطقة هي الأشد انخفاضًا في العالم. البحر الميت وكمية المياه التي تصب فيه من الأنهار قليلة نسبيا، ومعدل الأمطار السنوية لا تتعدى ١٠ سم في شماله وه سم في جنوبه ومنطقته حارة وجافة، لذا فإن معدل تبخر الماء منه كبير جدا، مما يزيد من ملوحته. ويصل تركيز الأملاح فيه ٣٥ جراما / ۱۰۰ جرام ماء؛ أي عشرة أضعاف متوسط تركيزها في مياه البحار والمحيطات الأخرى، لذا فهو يخلو من الأسماك، وتكاد تنعدم فيه الحياة. مياه مالحة جدا الملح يخفف الألم و يُعد ماء الغرغرة المالح مادة معقمة؛ فهو يقاوم البكتيريا التي تسبب التهابات القصبة الهوائية. شكلا بيانيا ارسم شكلا ابحث في المصادر المختلفة ومنها شبكة الإنترنت عن أيونات العناصر الأخرى في ماء البحر، وصمّم رسا يُظهر الكميات الموجودة لأكثر عشرة أملاح شيوعًا في لتر من ماء البحر. وزارة التعليم Ministry of Education 2024-1446

دليل مراجعة الفصل مراجعة الأفكار الرئيسة الدرس الأول المحاليل والذائبية العناصر والمركبات مواد نقية؛ لأن تركيبها ثابت. أما المخاليط فليست مواد نقية. .٢ المخاليط غير المتجانسة لا تختلط مكوناتها بانتظام. أما المخاليط المتجانسة فتختلط مكوناتها بانتظام على المستوى الجزيئي، وتسمى أيضًا المحاليل. . يمكن أن تكون المواد المذابة والمواد المذيبة غازات أو سوائل أو مواد صلبة. الدرس الثاني المحاليل الحمضية والمحاليل القاعدية .. الأحماض تطلق أيونات الهيدروجين "H وتنتج أيونات الهيدرونيوم عند ذوبانها في الماء. والقواعد تستقبل أيونات * وتنتج أيونات الهيدروكسيد OH عند ذوبانها في الماء. يعبر مقياس الحموضة pH عن تركيز أيونات الهيدرونيوم وأيونات الهيدروكسيد في المحاليل المائية. .٤ الماء مذيب عام يمكن أن يذيب العديد من المواد في تفاعل التعادل، يتفاعل حمض مع المختلفة؛ لأن جزيئاته ،قطبية، والمثل يذيب المثل. تتأثر الذائبية بدرجة الحرارة والضغط. ٦. المحاليل يمكن أن تكون غير مشبعة، أو مشبعة أو فوق الإشباع ؛ اعتمادًا على كمية المذاب الذائبة مقارنة بذائبية المذاب في المذيب. . تركيز المحلول هو كمية المذاب في حجم معين من عن التفاعل ملح وماء. قاعدة وينتج المذيب. تصور الأفكار الرئيسة انسخ الخريطة المفاهيمية التالية التي تتعلق بتصنيف المادة، وأكملها: يمكن أن تكون يمكن أن تكون المادة المخاليط يمكن أن تكون يمكن أن تكون مركبات غير متجانسة تتركب من تتركب من نوع واحد من الذرات تتركب من تتركب من عناصر و / أو مركبات مخلوطة بانتظام وزارة التعليم Ministry of Education 2024-1446

مراجعة الفصل استخدام المفردات املأ الفراغ فيما يلي بالكلمة المناسبة: ١ قيمة ١١ . أي مما يلي يمكن التقليل منه للحد من ذوبان المادة الصلبة في السائل؟ أ. حجم الجزيئات ج. درجة الحرارة . للقاعدة أكثر من ٧ . . الضغط د. حجم العبوة .٢ كمية المذاب في محلول تمثل . كمية المذاب التي تذوب في ١٠٠ جرام من المذيب تمثل مادة تذوب لتكوين محلول ه التفاعل بين حمض وقاعدة يسمى 7 لها تركيب ثابت. تثبيت المفاهيم اختر الإجابة الصحيحة فيما يلي: أي مما يلي محلول؟ أ. الماء النقي ١٢ . أي الأحماض التالية يستخدم في العمليات الصناعية لتنظيف الفلزات؟ .أ. الهيدروكلوريك ب. الكربونيك ج. الكبريتيك د النيتريك 13 . إذا تم تحضير محلول بإضافة ١٠٠ جرام من هیدروكسيد الصوديوم الصلب NaOH إلى ۱۰۰۰ مل ماء. فماذا تمثل المادة الصلبة NaOH؟ أ. محلول ب. مذاب ج. مذيب د. مخلوط ب.كعكة الزبيب ج. النحاس د. الخل أي نوع من المركبات التالية لا يذوب في الماء؟ ١٤. أيُّ التراكيز المتساوية الآتية ينتج أيونات هيدرونيوم أكثر في محلول مائي؟ أ. القاعدة القوية ب. القاعدة الضعيفة ج. الحمض القوي د الحمض الضعيف ١٥ . العصارة الصفراء سائل حمضي يفرزه الجسم للمساعدة على الهضم، وتركيز أيونات الهيدرونيوم أ. القطبية ج. غير القطبية ب. الأيونية د. المشحونة ٩ ما نوع جزيء الماء؟ أ. قطبي ج. غير قطبي أ. صفر ب. أيوني د. راسب ب. ۷ فيه عال. ما الرقم الهيدروجيني المتوقع له ؟ ج. أقل من ٧ د. أكبر من ٧ ١٠ . ماذا يمثل الماء عند إذابة مركبات الكلور في ماء ١٦ . ما الذي يحدث لحمض معدتك عندما تبتلع حبة المسبح (البركة)؟ أ. السبيكة ج. المحلول ب. المذيب د. المذاب مضاد للحموضة؟ أ. يصبح أكثر حمضية جـ. يُخفّف ب. يصبح أكثر قاعدية د. يتعادل وزارة التعليم Ministry of Education 2024-1446

إذا تم تحضير محلول بإضافة ١٠٠ جرام من هيدروكسيد الصوديوم الصلب NaOH إلى 1000 مل ماء فماذا تمثل المادة الصلبة NaOH


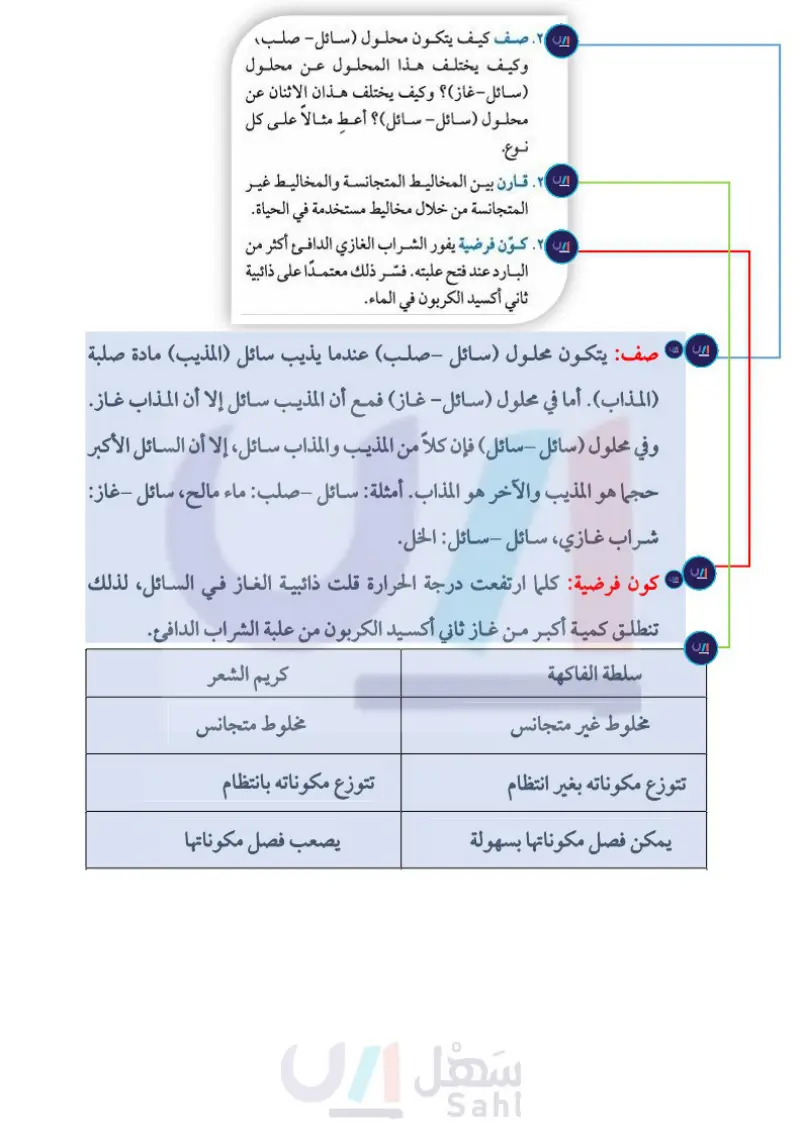
التفكير الناقد مراجعة الفصل في التفاعلات الكيميائية. كيف يحدث ذلك؟ ١٧ . وضح ظروف تكوّن البلورات والرواسب في ۲۲ صف كيف يتكون محلول (سائل- صلب)؟ المحاليل. ١٨. وضح كيف تحصل على محلول مخفّف من حمض قوي؟ ۱۸ وكيف يختلف هذا المحلول عن محلول سائل - غاز) ؟ وكيف يختلف هذان الاثنان عن محلول (سائل - سائل) ؟ أعط مثالا على كل نوع. ۱۹. استخلص النتائج يضاف مانع التجمد في مبرد ۲۳. قارن بين المخاليط المتجانسة والمخاليط غير السيارة (الرادياتير) لمنع تجمد الماء فيه في أشهر المتجانسة من خلال مخاليط مستخدمة في الحياة. البرد . ويقوم أيضًا بمنع غليان الماء أو ارتفاع درجة ٢٤ . كوّن فرضية يفور الشراب الغازي الدافئ أكثر من البارد عند فتح علبته فسّر ذلك معتمدًا على ذائبية حرارته فوق درجة الغليان . كيف يقوم بذلك؟ استخدم التوضيح التالي للإجابة عن السؤال ٢٠. 7 V الكريسول الأحمر الثيمول الأزرق البروموفينول الأزرق البرومو كريسول الأخضر البنفسج البلوري البرومو كريسول الأرجواني ثاني أكسيد الكربون في الماء. أنشطة تقويم الأداء ٢٥. كتابة مقالة اكتب مقالة توضح فيها الاختلافات بين المادة النقية والمخلوط. تطبيق الرياضيات استخدم الشكل أدناه للإجابة عن السؤال ٢٦ . الذائبية الأليزارين البروموتيمول الأزرق الفينول الأحمر الكاشف العالمي كلوريد البوتاسيوم كلوريد الصوديوم 10 20 30 40 50 60 70 80 90 140 120 100 80 60 40 20 الذائبية جرام 100 جرام ماء ۲۰ . فسّر يستخدم الكيميائيون كواشف مختلفة. . من درجة الحرارة ( س ) المهم استخدام الكاشف الصحيح؛ حيث يتغير ٢٦. الذائبية مستخدما الرسم البياني للذائبية أعلاه، قدر اللون عند الرقم الهيدروجيني المناسب، وإلا كانت النتيجة مضللة . اعتمادًا على الشكل، ما الكواشف التي تستخدم ليتغير اللون عند كل من القيمتين ۲ و ۸؟ ۲۱. وضّح يمكن لجزيئات الماء أن تنفصل إلى أيونات H و OH. ومن المعلوم أن الماء مادة مترددة، أي يمكن أن تمثل حمضًا أحيانًا وقاعدة أحيانًا أخرى ذائبية كل من كلوريد البوتاسيوم وكلوريد الصوديوم في الماء عند ٨٠ س. ۲۷. تركيز العصير إذا عملت شرابًا في وعاء سعته ١٠٠ مل، فما حجم مسحوق العصير الذي وضعته فيه لتكون نسبة العصير في الشراب ١٨%؟ وزارة التعليم Ministry of Education 2024-1446

يضاف مانع التجمد في مبرد السيارة (الرادياتير) لمنع تجمد الماء فيه في أشهر البرد ويقوم أيضا بمنع غليان الماء أو ارتفاع درجة حرارته فوق درجة الغليان كيف يقوم بذلك؟


وضح يمكن لجزيئات الماء أن تنفصل إلى أيونات HوOH ومن المعلوم أن الماء مادة مترددة أي يمكن أن تمثل حمضا أحيانا وقاعدة أحيانا أخرى


الوحدة 1 اختبار مقنن الجزء الأول: أسئلة الاختيار من متعدد استخدم الصورة في الإجابة عن السؤال ۱ . ١. أي خطوات الطريقة العلمية توضحها الصورة أعلاه؟ أ. الملاحظة جـ. الفرضية ب. استخلاص النتائج د. جمع البيانات وتحليلها ٢. ما الذي يصف أو يتوقع سلوك الأشياء في الطبيعة؟ أ. الفرضية ب. القانون ج. الاستنتاج د. النظرية ٦. أي مما يأتي يصف الغلاف الجوي؟ أ. مشبع ب. محلول ج. راسب د. کاشف .٧ ما الغاز الذي يعدّ مذيبًا للهواء الجوي؟ أ. النيتروجين ج. بخار الماء ب. الأكسجين د. ثاني أكسيد الكربون ۸. ما الخاصية التي تشترك فيها المحاليل المائية ؟ أ. تحتوي على أكثر من ثلاث مواد مذابة. ب لا يوجد فيها مواد صلبة أو غازية مذابة. ج. جميعها عالية التركيز. د. الماء هو المذيب فيها. عند دراسة العلاقة بين ذائبية مادة ودرجة الحرارة استخدم الرسم في الإجابة عن السؤال ۹. يكون المتغير المستقل هو : أ. كتلة المادة ب. درجة الحرارة جـ. ذائبية المادة د. كتلة المذيب .. تعدّ أجهزة الحاسوب والمجاهر من الأمثلة على : أ. الفرضيات ب. المتغيرات جـ. التقنية د. الثوابت الذائبية سكر كلوريد البوتاسيوم ٥٢٠ ٤٨٠ ٤٤٠ ٤٠٠ ٣٦٠ ٣٢٠ ۲۸۰ ٢٤٠ ۲۰۰ 17. ۱۲۰ الذائبية جرام / ١٠٠ جرام ماء ه. أي مما يأتي يستعمل في اختبار الفرضية؟ أ. التجربة ب. النظرية ج. القانون د. المتغير استخدم الشكل أدناه في الإجابة عن السؤالين ٦ و ٧ . تركيب الهواء الجوي نيتروجين ٧٨ أكسجين ۲۱ بخار ماء، وثاني أكسيد الكربون، وغازات أخرى 1% ۰ ۱۰ ۲۰ ۳۰ ۴۰ ۵۰ ۲۰ ۷۰۸۰۹۰ درجة الحرارة (س) .. ما العبارة الصحيحة مما يأتي؟ ۸۰ ٤٠ أ. كلوريد البوتاسيوم أكثر ذوبانًا في الماء من السكر. ب. بازدياد درجة حرارة الماء تقل ذائبية كلوريد البوتاسيوم. جـ. السكر أكثر ذوبانًا في الماء من كلوريد البوتاسيوم. .. لا تؤثر درجة حرارة الماء في ذائبية المادتين. ٦٢ وزارة التعليم Ministry of Education 2024-1446

استخدم الشكل أدناه للإجابة عن السؤالين 6 و7
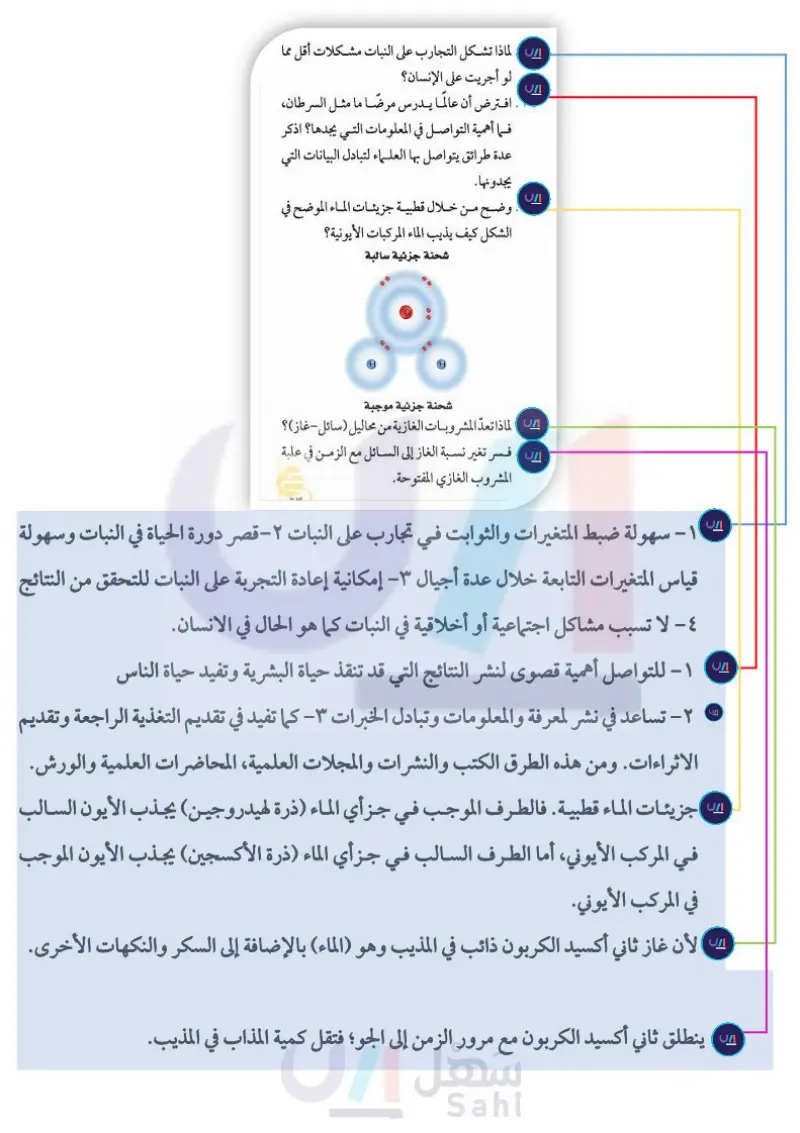
اختبار مقنن الجزء الثاني : أسئلة الإجابات القصيرة استخدم الصورة أدناه في الإجابة عن السؤال ١٠ . الجزء الثالث | أسئلة الإجابات المفتوحة .١٠ . أكمل الجدول بتحديد ما إذا كانت كل جملة فيه تمثل ۱۸ . لماذا تشكل التجارب على النبات مشكلات أقل مما ملاحظة، أو استنتاجا أو فرضيةً. الجملة ملاحظة أو استنتاج أو فرضية لو أجريت على الإنسان؟ ۱۹. افترض أن عالما يدرس مرضًا ما مثل السرطان، فما أهمية التواصل في المعلومات التي يجدها؟ اذكر عدة طرائق يتواصل بها العلماء لتبادل البيانات التي يجدونها. . وضح من خلال قطبية جزيئات الماء الموضح في الشكل كيف يذيب الماء المركبات الأيونية؟ شحنة جزئية سالبة يحتاج النبات إلى كمية كبيرة من الماء النبات له أوراق كبيرة ليس للنبات أزهار قد يكون شيء ما أكل النبات إذا نقل النبات إلى مكان آخر سيكون أفضل قد يحتاج النبات إلى أشعة شمس أكثر سيصبح النبات أفضل عند استعمال مبيد حشري ١١ . كيف تصبح الفرضية نظرية ؟ ۱۲ . ماذا يحدث إذا لم تدون الملاحظات كما ينبغي ؟ ١٣ . ما الفرق بين الاستنتاج والفرضية ؟ استخدم الصورة في الإجابة عن السؤال ١٤ . O شحنة جزئية موجبة ۲۱ . لماذا تعدّ المشروبات الغازية من محاليل (سائل-غاز)؟ ۲۲ . فسر تغير نسبة الغاز إلى السائل مع الزمن في علبة المشروب الغازي المفتوحة. أتدرب ١٤ . ما نوع المخلوط ؟ اذكر ثلاثة أمثلة عليه. ١٥ . المذاب في صورة حبيبات أو قطع يذوب أسرع منه إذا كان في صورة قطعة كاملة. فسر ذلك. ١٦ . قارن بين تركيز المحلولين المحلول (أ) يتكون من ه جرامات كلوريد الصوديوم مذابة في ١٠٠ جرام ماء، والمحلول (ب) يتكون من ۲۷ جرام كلوريد الصوديوم مذابة في ١٠٠ جرام ماء. ۱۷ . صف كيف تستخدم أوراق تباع الشمس لتحديد الرقم الهيدروجيني pH محلول؟ . من خلال الإجابة على الأسئلة؛ حتى أعزّز ما تعلمته من مفاهيم وما اكتسبته من مهارات أنا طالب معد للحياة، ومنافس عالميًا ٦٣ وزارة التعليم Ministry of Education 2024-1446




 0
0 

 0
0 

 0
0 

 1
1